
| 要提纯的物质 (杂质) | 溴乙烷 (乙醇) | 乙醇 (水) | 乙醇 (乙酸) | 溴苯 (溴) | 苯 (苯酚) |
| (1)选用试剂 | |||||
| (2)分离方法 |
| 要提纯的物质(杂质) | CH3CH2Br (C2H5OH) | C2H5OH (H2O) | CH3CH2OH (CH3COOH) | C6H5Br (Br2) | C6H6 (C6H5OH) |
| 选用试剂(1) | e | c | b或d | b | b |
| 分离方法(2) | B | C | C | B | B |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、碳棒上放出Cl2 |
| B、碳棒附近产生OH- |
| C、碳棒上放出O2 |
| D、铁钉被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3 mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
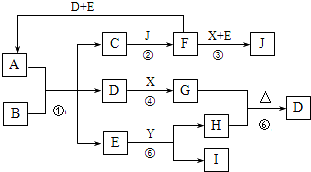
查看答案和解析>>
科目:高中化学 来源: 题型:

| 错误观点 | 离子方程式 | |
| ① | 所有的离子方程式均可以表示一类反应 | |
| ② | 所有酸碱中和反应均可表示为:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com