
【题目】黑火药是我国古代四大发明之一,它的爆炸反应为:2KNO3+3C+S![]() K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
完成下列填空:
(1)上述反应中的还原剂为___,还原产物有___,当有1molKNO3参加反应时,转移电子的数目为___。
(2)KNO3晶体类型是___,其晶体中存在的化学键有___。
(3)硫原子的核外电子排布式为___,原子核外有___种不同能量的电子。将SO2和Cl2分别通入品红溶液中,产生的现象是___;若将SO2和Cl2等体积混合后再缓缓通入品红溶液,发现品红溶液___,其原因是___。
(4)S、C和N三种元素的原子半径从小到大的顺序是___;K2S溶液中除OH-外其它各离子物质的量浓度的大小顺序为___。
(5)下列事实能说明碳与硫两元素非金属性相对强弱的有___。
a.同温同浓度溶液pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
d.分解温度:CH4>H2S
【答案】C K2S和N2 6NA 离子晶体 离子键、共价键 1s22s22p63s23p4或[Ne]3s23p4 5 品红溶液均褪色 不褪色 将SO2和Cl2等体积混合后在溶液中恰好完全反应生成了盐酸和硫酸,不再具有漂白性(或SO2+Cl2+2H2O=H2SO4+2HCl,盐酸和硫酸无漂白性) N<C<S c(K+)>c(S2-)>c(HS-)>c(H+) ac
【解析】
(1)该反应中N、S元素化合价均降低,C元素化合价升高,因此还原剂为C;还原产物为K2S和N2;当有1molKNO3参加反应时,有1.5molC参加反应,C元素化合价从0价升高至+4价,因此转移数目为1.5mol×4NAmol-1=6NA;
(2)KNO3为活泼金属阳离子与含氧酸根阴离子组成的化合物,其晶体类型属于离子晶体;晶体中阴阳离子通过离子键连接,硝酸根内N原子与O原子之间通过共价键连接,因此KNO3晶体中存在离子键、共价键;
(3)S原子核内质子数为16,核外电子数为16,因此核外电子排布式为:1s22s22p63s23p4或[Ne]3s23p4;核外电子分别处于5个不同的能级中,因此原子核外有5种不同能量的电子;SO2具有漂白性,能够使品红溶液褪色,Cl2与水反应生成的HClO具有漂白性,能够使品红溶液褪色;将SO2和Cl2等体积混合后再缓缓通入品红溶液,SO2与Cl2在水中能够发生反应:SO2+Cl2+2H2O=H2SO4+2HCl,生成的HCl、H2SO4均不具有漂白性,因此不能使品红溶液褪色;
(4)C、N原子核外电子层数小于S,因此S原子半径最大,C、N处于同一周期,核外电子层数相同,质子数越大,其半径越小,因此半径相对大小关系为:N<C<S;K2S属于强碱弱酸盐,在溶液中能够发生水解,S2-一级水解程度>S2-二级水解程度>水的电离程度,因此溶液中除OH-外离子浓度关系为:c(K+)>c(S2-)>c(HS-)>c(H+);
(5)a.同温同浓度溶液pH:Na2CO3>Na2SO4,根据“越弱越水解”,说明酸性:H2SO4>H2CO3,H2SO4、H2CO3分别对应S、C的最高价氧化物对应水化物,可说明非金属性:S>C,故a符合题意 ;
b.酸性:H2SO3>H2CO3,说明亚硫酸电离出氢离子的能力强于碳酸,因H2SO3并非S元素对应最高价氧化物对应水化物,不能说明碳元素与硫元素非金属性相对强弱,故b不符合题意;
c.CS2中碳元素为+4价,硫元素为-2价,可直接说明S的非金属性强于C,所以S才显负价,碳元素显示正价,故c符合题意;
d.分解温度:CH4>H2S,其原因是C、S均采取sp3杂化,CH4为非极性分子,H-C键能较强,在1000℃左右分解,而H2S为极性分子,H-S-H键角为92.1,由于H-S键能较弱,导致H2S在300℃左右分解,故不能据此比较C元素与S元素非金属性,故d不符合题意;
故答案为:ac。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C的原子序数依次增大,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是( )
A.原子半径:A<B<C
B.三种元素的最高价氧化物对应水化物均可由化合反应得到
C.A的氢化物稳定性小于C的氢化物稳定性
D.B 和A的最高价氧化物可发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s) ![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化合物M(仅含三种短周期元素)是一种储氢材料。为探究M的组成和性质,设计并完成如下实验:
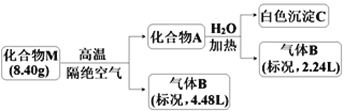
已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。
请回答:(1)化合物M的组成元素是______________(用元素符号表示)。
(2)化合物A与水反应的化学方程式是______________________。
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是______。
II.无机盐X仅由三种短周期元素组成,其相对分子质量为238,原子个数比为1︰1︰4。将23.8gX与水共热,生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀。请推测并回答:
(4)单质A有很强的氧化性,可用于净化空气,饮用水消毒等。A中组成元素的简单离子结构示意图为___________________________。
(5)X的化学式_____________。
(6)实验室可通过低温电解B溶液制备X。该电解反应的化学方程式___________________。
(7)X氧化能力强,对环境友好,可用于脱硝、脱硫。在碱性条件下,X氧化NO的离子方程式_____________________。
(8)X溶液与铜反应时先慢后快。某同学认为除反应放热这一因素外,还有一种可能是反应生成的Cu2+对后续反应起催化作用,为此他设计了如下实验方案:取少量铜粉置于试管中,先加入少量CuSO4溶液,再加入X溶液,振荡,观察现象。若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之Cu2+不起作用。写出X与铜反应的化学方程式________,判断该同学设计的验证方法合理性并说明理由_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列曲线中,纵坐标表示生成氢氧化铝的量,横坐标表示加入试剂的体积。从下边图中选出选项:
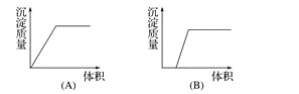
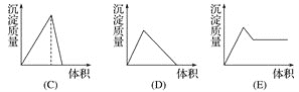
(1)向盐酸酸化的氯化铝溶液中逐滴滴入氨水至过量__________。
(2)向氢氧化钠与偏铝酸钠混合液中通入二氧化碳过量__________。
(3)向氨水中逐滴滴入氯化铝溶液至过量__________。
(4)向氯化铝溶液中滴加氢氧化钠至过量__________。
(5)向偏铝酸钠溶液滴加盐酸至过量______________。
(6)向氯化镁和氯化铝混合液中加氢氧化钠至过量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验台上有序摆放整齐的药品中,有一瓶标签破损的试剂(见图).这瓶标签破损的溶液最有可能是( )
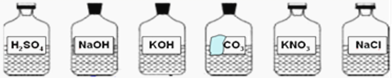
A.Na2CO3B.H2CO3C.BaCO3D.CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用铁铆钉固定两个铜质零件的示意图,若该零件置于潮湿空气中,下列说法正确的是
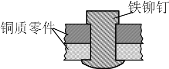
A.发生电化学腐蚀,铜为负极,铜极产生H2
B.铜易被腐蚀,铜极上发生还原反应,吸收O2
C.铁易被腐蚀,铁发生氧化反应,Fe-2e-=Fe2+
D.发生化学腐蚀:Fe + Cu2+ = Cu + Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是![]()
![]()
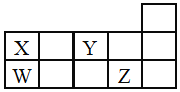
A.四种元素中原子半径最大为W,Y元素通常没有最高正价
B.酸性:![]()
C.![]() 、
、![]() 中所含化学键类型相同,熔点都很高
中所含化学键类型相同,熔点都很高
D.W、X形成的单质都是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是一种应用广泛的金属,钠及其化合物在生产生活中应用广泛。某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
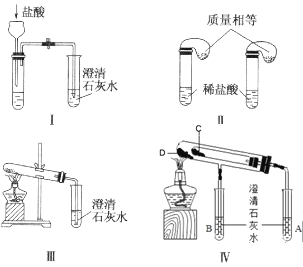
(1)只根据图中装置Ⅰ、Ⅱ所示实验,能够达到实验目的的是__(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式__、__;Ⅳ中现象为___;与实验Ⅲ相比,实验Ⅳ的优点___。
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管C中装入的固体是__(填化学式)。
(4)将适量钠投入下列溶液中,既能产生大量气体又能生成沉淀的是__(填写字母)
A.稀硫酸 B.氯化钠溶液 C.氯化镁溶液 D.硫酸铜溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com