实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO
2)和氯化铵的混合溶液加热,氮元素全部转化为氮气.进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):
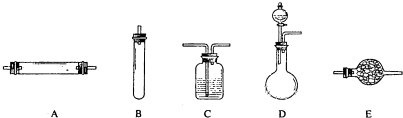
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用
(选填装置编号).请写出生石灰在此反应中的两个作用:
,
.
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置
(选填装置编号)中加入
以除去其它杂质气体.
(3)方法三:制氮气的化学方程式为:
.
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂.在制取氮气的3种方法中,联合使用方法-和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:
.
(5)1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右.若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:
.



