
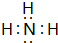 B位于周期表中第二周期ⅦA族.
B位于周期表中第二周期ⅦA族.分析 A、B、C、D为原子序数依次增大的短周期元素,A元素气态氢化物的水溶液呈碱性,则A为N元素;B为最活泼的非金属元素,则B为F元素;C元素的原子的电子层数是最外层电子数的3倍,最外层电子数只能为1,原子只能有3个电子层,故C为Na元素;D元素最高化合价为+6价,则D为S元素.
(1)A元素气态氢化物为NH3;主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)根据摩尔质量计算SFn中n的值,进而确定化学式;该物质在温度高于45度时为气态,沸点很低,属于分子晶体;从S元素化合价及氟气的氧化性比氧气的强分析解答;
(3)C与氢元素组成1:1的化合物NaH,与水发生剧烈反应生成一种气体,实质为水解反应,该气体为氢气,反应还生成NaOH;
(4)计算氮气的物质的量,根据质量守恒计算Na的质量,再计算钠的物质的量,可以确定甲的化学式,进而书写反应方程式;
(5)D 元素的+4价含氧酸钠盐为Na2SO3,该钠盐在空气中容易变质生成Na2SO4,利用氯化钡溶液检验药品中是否含有硫酸根离子,向用盐酸排除亚硫酸根离子影响.
解答 解:A、B、C、D为原子序数依次增大的短周期元素,A元素气态氢化物的水溶液呈碱性,则A为N元素;B为最活泼的非金属元素,则B为F元素;C元素的原子的电子层数是最外层电子数的3倍,最外层电子数只能为1,原子只能有3个电子层,故C为Na元素;D元素最高化合价为+6价,则D为S元素.
(1)A元素气态氢化物为NH3,电子式为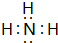 ,B为F元素,位于周期表中第二周期ⅦA族,
,B为F元素,位于周期表中第二周期ⅦA族,
故答案为: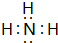 ;二、ⅦA;
;二、ⅦA;
(2)SFn做制冷剂替代氟利昂,该物质的摩尔质量为146g•mol-1,则n=$\frac{146-32}{19}$=6,该物质的化学式为SF6,已知SF6 在温度高于45度时为气态,沸点很低,SF6属于分子晶体.该物质在空气中不能燃烧,从氧化还原角度分析不能燃烧的理由:SF6中硫元素是最高价不能再被氧化,氟单质的氧化性比氧气强,负价的氟不能与氧气反应,
故答案为:SF6;分子;SF6中硫元素是最高价不能再被氧化,氟单质的氧化性比氧气强,负价的氟不能与氧气反应;
(3)C与氢元素组成1:1的化合物NaH,与水发生剧烈反应生成一种气体,该气体为氢气,该反应化学反应方程式:NaH+H2O═NaOH+H2↑,生成1mol气体消耗1molNaH,转移的电子的数目为:1mol,
故答案为:NaH+H2O═NaOH+H2↑;1mol;
(4)A和C两元素可形成化合物甲,取13.0g化合物甲,加热使其完全分解,生成氮气、Na,生成氮气的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,则Na的质量为13g-0.3mol×28g/mol=4.6g,故Na的物质的量为$\frac{4.6g}{23g/mol}$=0.2mol,则甲中Na、N原子数目之比为0.2mol:0.3mol×2=1:3,则甲为NaN3,化合物甲分解方程式为:2NaN3$\frac{\underline{\;\;△\;\;}}{\;}$2Na+3N2↑,
故答案为:2NaN3$\frac{\underline{\;\;△\;\;}}{\;}$2Na+3N2↑;
(5)D 元素的+4价含氧酸钠盐为Na2SO3,该钠盐在空气中容易变质生成Na2SO4,证明该盐已经变质的实验方案:取样于试管中,加入足量稀盐酸,再滴加氯化钡,若有白色沉淀,证明已经变质,
故答案为:取样于试管中,加入足量稀盐酸,再滴加氯化钡,若有白色沉淀,证明已经变质.
点评 本题以元素推断为载体,考查电子式、物质推断、晶体类型与性质、氧化还原反应、化学方程式书写、实验方案设计等,是对基础知识的综合考查,需要学生基本扎实的基础.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混合后在光照的条件下发生反应 | |
| B. | 甲苯与Br2发生反应 | |
| C. | 乙炔与氢气的加成反应 | |
| D. | 乙烯与氯化氢的加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
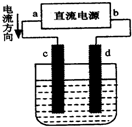
| A. | d为负极、c为正极 | B. | c电极上发生还原反应有气体产生 | ||
| C. | 电解过程中,氯离子向d电极移动 | D. | 电解过程中,d电极质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 同主族元素性质的相似性 | 钠和氧反应可以形成Na2O2,也可以和硫形成Na2S2 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片分别加入足量的稀硫酸和浓硫酸中,浓硫酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | HF沸点低于HCl |
| D | 较强酸可以制取较弱酸 | 亚硫酸和次氯酸钙反应可以制取次氯酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2s22p2和2s22p4 | B. | 3s23p4和2s22p2 | C. | 3s2和3s23p5 | D. | 2s22p3和2s22p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ① | C. | ④ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
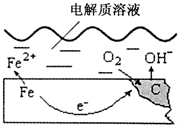 如图是钢铁在潮湿空气里发生电化学腐蚀的示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2.Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈.请根据图示,回答下列问题:
如图是钢铁在潮湿空气里发生电化学腐蚀的示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2.Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈.请根据图示,回答下列问题:| 物质 | 熔点/°C | 沸点/°C | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com