
【题目】Ⅰ、用纯净的碳酸钙粉末跟稀盐酸反应制取二氧化碳气体,请回答下列问题:

(1)实验过程如图所示,分析判断:________段化学反应速率最快。由该段图象说明:此反应属于________(填“吸热”或“放热”)反应。
(2)为了减缓上述反应的化学反应速率,欲向溶液中加入下列物质,你认为可行的是___(填字母)。
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.浓盐酸
(3)要减缓化学反应速率,除了上述方法外,你认为还可以采取的措施是_________。
Ⅱ、下图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。
2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。

(1)若Z和X为气体,则Y为____体(填气或非气)。
(2)升高温度,v正____,v逆____(填增大或减小)。
(3)此平衡的平衡常数计算公式为:____________,温度升高,K____(填增大或减小)。
【答案】 EF 放热 AC 用块状大理石、石灰石代替纯净的碳酸钙粉末或降低反应温度 非气 增大 增大 ![]() 增大
增大
【解析】本题考查化学反应速率和化学平衡的影响因素。
解析:Ⅰ、(1)曲线斜率大小决定反应速率大小,斜率越大,反应速率越快,所以是EF段;EF段反应速率更快,是因该反应为放热反应,温度升高,反应速率加快;(2)反应物的浓度越大,反应速率越快,所以只要使反应物浓度变小即可。加蒸馏水,盐酸浓度变小,反应速率减小,故A正确;加氯化钠固体,盐酸浓度不变,反应速率不变,故B错误;加氯化钠溶液,溶液体积增大,盐酸浓度降低,反应速率减小,故C正确;加浓盐酸,盐酸浓度增大,反应速率加快,故D错误。故选AC;(3)要减缓化学反应速率,除了上述方法外,还可以改变固体反应物的体积、溶液的温度、把强电解质换成弱电解质等,如用块状大理石或石灰石代替纯净的碳酸钙或降低反应温度等。
Ⅱ、(1)当温度相同时,压强越大,生成物Z的含量越小,这说明增大压强,平衡向逆反应方向移动,说明正反应是体积增大的反应,若X、Y、Z均为气态,则反应前后气体的体积不变,因Z和X为气体,所以Y只能是非气体;(2)升高温度,化学反应速率增大,v正、v逆均增大;(3)因Y为非气体,所以反应X+Y![]() 2Z的平衡的平衡常数计算公式为
2Z的平衡的平衡常数计算公式为![]() ;由图象曲线变化可知,随着温度的升高,Z的体积分数增大,说明升高温度平衡向正反应方向移动,说明正反应吸热,所以温度升高,K增大。
;由图象曲线变化可知,随着温度的升高,Z的体积分数增大,说明升高温度平衡向正反应方向移动,说明正反应吸热,所以温度升高,K增大。


科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:

(1)原NaOH溶液的物质的量浓度为_______________。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是____________,其物质的量之比为___。
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况下)的最大值为____mL。
(4)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 此物质分子式为C5H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是ⅥA族部分元素的相关性质。
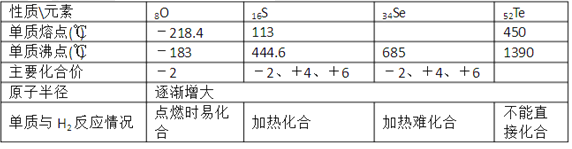
请回答下列问题:
(l)硒的熔点范围可能是____。
(2)碲的化合价可能有____。
(3)氢硒酸有较强的 ____填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生反应的化学方程式为____。
(4)工业上Al2Te可用来制备H2Te,完成下列化学方程式:___ Al2Te3+___ =2Al(OH)3↓+____H2Te↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
①静电除尘利用了胶体带电的性质
②水玻璃可用作制备木材防火剂的原料
③光导纤维和计算机芯片的主要成分是SiO2,太阳能电池的主要成分是硅
④常温下,铝制容器盛放稀硫酸
⑤三氧化二铝可以做耐火材料
A. ②⑤ B. ①③④ C. ①③⑤ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)
如图所示是配制50 mL KMnO4标准溶液的过程示意图。
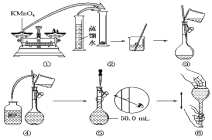
(1)请你观察图示判断,其中不正确的操作有__________ (填序号)。
(2)其中确定50 mL溶液体积的容器是________(填名称)。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)
抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)配平草酸与KMnO4反应的离子方程式:__MnO+ H2C2O4+ H+=== Mn2++ CO2↑+ H2O。
(5)滴定终点时的现象是_____________________________________
(6)经过计算,血液样品中Ca2+的浓度为__________m mol·cm-3。
Ⅱ. 某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
实验1试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)。
操作 | 现象 |
取2 mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是_________。
(2)产生气泡的原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
步骤 | 操作 | 现象 |
I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
Fe3+ +![]() SO32- +
SO32- +![]() =
=![]() F e2+ +
F e2+ +![]() +
+![]()
![]()
乙同学查阅资料得知:
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
步骤 | 操作 | 现象 |
II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
步骤 | 操作 | 现象 |
III | 向1 molL-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池结构如图所示,下列有关该原电池的说法不正确的是

A. 能将化学能转换成电能
B. 电子从铁棒经外电路流向碳棒,再经稀硫酸流向铁棒,形成闭合回路
C. 碳棒上发生还原反应
D. 总反应为Fe+H2SO4= FeSO4+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com