
分析 由题意知溶液无色.则推知不含CuSO4溶液,有白色沉淀产生,可以推知有本身不溶于水的CaCO3存在或能相互反应生成BaSO4的Na2SO4和BaCl2的存在,然后依据加入稀硝酸沉淀部分溶解,则可以推断两种沉淀均存在,又通过加入强碱产生有刺激性气味的其体可以推断含有NH4NO3,对于KNO3只能为可能含有,以此解答该题.
解答 解:(1)将此固体粉末加到水中,得到白色沉淀和上层无色清液,由于硫酸铜溶液是蓝色的,故一定不含有CuSO4;得到的白色沉淀可能是CaCO3或BaSO4;
(2)过滤后,在滤出的白色沉淀里加入稀硝酸,白色沉淀部分溶解并有无色气体生成,该气体使澄清石灰水变浑浊,由于碳酸钙能与硝酸反应生成二氧化碳,故一定含有CaCO3;硫酸钡是不溶于稀硝酸的白色沉淀,故一定有BaSO4,所以原固体中含有Na2SO4和BaCl2;
(3)在滤液中,加入适量的氢氧化钠溶液并加热,生成有刺激性气味的无色气体,该气体能使湿润的红色石蕊试纸变蓝,说明生成了氨气,铵态氮肥能与碱性物质反应产生氨气,故原固体中一定含有NH4NO3,不能确定是否含有KNO3,
故答案为:Na2SO4、NH4NO3、CaCO3、BaCl2;CuSO4;KNO3.
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析能力以及元素化合物知识综合理解和运用的考查,注意把握物质的性质以及反应现象的判断,难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
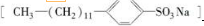 是常用洗涤剂的主要成分.
是常用洗涤剂的主要成分.
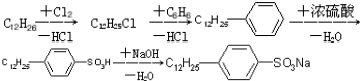
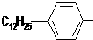 .
.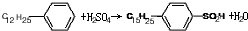 ,反应类型为取代反应.
,反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液不变浑浊.先通入CO2再通入氨气,溶液变浑浊 | CaCl2溶液 |
| B | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| C | 通 CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| D | 通 CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g≤m≤128g | B. | 36g<m<180g | C. | 18g<m<128g | D. | 36g<m≤180g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动,逆反应速率减小 | |
| B. | 平衡常数K增大 | |
| C. | NO2的转化率变大 | |
| D. | 容器内气体颜色先变深后变浅,最后比原来还要浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 苯能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇可以和金属钠反应放出氢气 | |
| D. | 乙酸可以与乙醇在一定条件下发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
| 难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.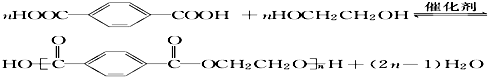 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com