
已知25℃时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中c(H+)=1.0×10-13 mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1×10-13 mol·L-1
C.所加烧碱溶液的pH=13.0
D.所得溶液中c(Mg2+)=5.6×10-10 mol·L-1
科目:高中化学 来源: 题型:
在3种不同条件下,分别向容积为2 L的恒容密闭容器中充入2 mol A和1 mol B,发生反应如下:2A(g)+B(g)2D(g)
ΔH=-Q kJ·mol-1。相关条件和数据见下表:
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| 达平衡时间/min | 40 | 10 | 30 |
| c(D)平衡/mol·L-1 | 0.5 | 0.5 | 0.15 |
| 反应的能量变化/kJ | Q1 | Q2 | Q3 |
下列说法正确的是( )
A.可用压强或密度是否发生变化判断上述反应是否达到平衡
B.实验Ⅱ可能隐含的条件是使用催化剂,实验Ⅲ达平衡时v(D)为0.005 mol·L-1·min-1
C.由表中信息可知Q>0,并有Q3<Q2=Q1=Q
D.实验Ⅰ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,达平衡时c(D)为1.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO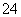 ,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO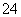 B.CrO
B.CrO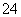 、Br-、Cl-
、Br-、Cl-
C.Br-、Cl-、CrO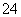 D.Br-、CrO
D.Br-、CrO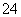 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12。如图是向10 mL AgNO3溶液中逐渐加入0.1 mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )

A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1
B.图中x点的坐标为(100,6)
C.图中x点表示溶液中Ag+被恰好完全沉淀
D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1 NaI则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
欲降低废水中重金属元素铬的毒性,可将Cr2O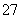 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
| 离子 | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
(1)某含铬废水处理的主要流程如图所示:
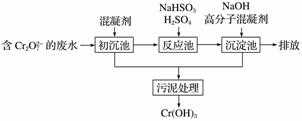
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为________________________(用离子方程式表示)。
②反应池中发生主要反应的离子方程式是Cr2O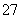 +3HSO
+3HSO +5H+===2Cr3++3SO
+5H+===2Cr3++3SO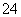 +4H2O。根据“沉
+4H2O。根据“沉
淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是________________________________________________________________________、
________________________________________________________________________。
证明Cr3+沉淀完全的方法是_________________________________________________。
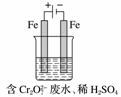
(2)工业可用电解法来处理含Cr2O 废水。实验室利用如图装置模拟处理含Cr2O
废水。实验室利用如图装置模拟处理含Cr2O 的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+
的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+
与酸性溶液中的Cr2O 反应的离子方程式是
反应的离子方程式是
________________________________________________________________________,
得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01 mol Cr2O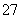 时,得到沉淀的质量至少是________g。
时,得到沉淀的质量至少是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:C2H5OH(g)+3O2(g)====2CO2(g)+3H2O(g) ΔH1=-a kJ/mol
C2H5OH(g)====C2H5OH(l) ΔH2=-b kJ/mol
H2O(g)====H2O(l) ΔH3=-c kJ/mol
若使92 g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为:
A.4a+4b+4c B.2a-2b+6c C.2a-2b+2c D.2a-6b+2c
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
| 元素符号 | 元素性质或原子结构 |
| A | A是形成化合物最多的元素 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置 ;
(2)B的最简单气态氢化物分子空间构型 ;其沸点高于同主族的其它气态氢化物原因 ;
(3)D的最高价氧化物对应水化物的化学键类型 ;
(4)B、C、D、E简单离子半径大小 (用元素符号表示);
(5)由A、B、C与H元素组成的一种常见的酸式盐与过量的D的最高价氧化物对应的水化物反应的离子方程式 ,在25℃,101kPa下,2gE单质在C2气体中完全燃烧后恢复到原状态,放热18.72kJ,该反应的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
从溴乙烷制取1,2二溴乙烷,下列制备方案中最好的是( )
A.CH3CH2Br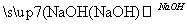 CH3CH2OH
CH3CH2OH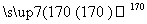 CH2===CH2
CH2===CH2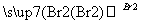 CH2BrCH2Br
CH2BrCH2Br
B.CH3CH2Br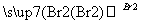 CH2BrCH2Br
CH2BrCH2Br
C.CH3CH2Br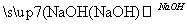 CH2===CH2
CH2===CH2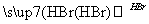 CH3CH2Br
CH3CH2Br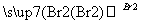 CH2BrCH2Br
CH2BrCH2Br
D.CH3CH2Br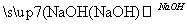 CH2===CH2
CH2===CH2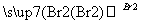 CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com