
 HCO3-+OH-ЃЈ2ЗжЃЉ
HCO3-+OH-ЃЈ2ЗжЃЉ CO2Ёќ+H2OЃЈ2ЗжЃЉ
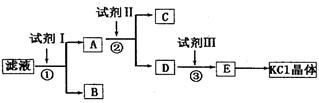
CO2Ёќ+H2OЃЈ2ЗжЃЉ HCO3-+OH-ЃЌШмвКГЪМюадЃЌPHЃО7ЃЛЃЈ2ЃЉвЊГ§ЕєдгжЪРызгСђЫсИљКЭЬМЫсИљЃЌгІЯШМгШыЙ§СПЕФТШЛЏБЕШмвКЃЌЬМЫсИљКЭСђЫсИљгыБЕРызгЗДгІЩњГЩСђЫсБЕКЭЬМЫсБЕГСЕэЃЌРызгЗНГЬЪНЮЊЃКSO42-+Ba2+=BaSO4Ё§ЃЌCO32-+Ba2+=BaCO3Ё§ЃЛЃЈ3ЃЉвЊГ§ЕєЖргрЕФБЕРызгЃЌашМгШыЙ§СПЬМЫсМиШмвКЃЌЬМЫсМиКЭТШЛЏБЕЗДгІЩњГЩЬМЫсБЕГСЕэЃЌРызгЗНГЬЪНЮЊCO32-+Ba2+=BaCO3Ё§ЃЛЃЈ4ЃЉвЊГ§ЕєЖргрЕФЬМЫсИљЃЌвЊЕЮМгЪЪСПЕФбЮЫсЃЌЬМЫсИљРызгКЭбЮЫсЗДгІЩњГЩЖўбѕЛЏЬМКЭЫЎЃЌРызгЗНГЬЪНЮЊCO32-+2H+=CO2Ёќ+H2OЁЃ
HCO3-+OH-ЃЌШмвКГЪМюадЃЌPHЃО7ЃЛЃЈ2ЃЉвЊГ§ЕєдгжЪРызгСђЫсИљКЭЬМЫсИљЃЌгІЯШМгШыЙ§СПЕФТШЛЏБЕШмвКЃЌЬМЫсИљКЭСђЫсИљгыБЕРызгЗДгІЩњГЩСђЫсБЕКЭЬМЫсБЕГСЕэЃЌРызгЗНГЬЪНЮЊЃКSO42-+Ba2+=BaSO4Ё§ЃЌCO32-+Ba2+=BaCO3Ё§ЃЛЃЈ3ЃЉвЊГ§ЕєЖргрЕФБЕРызгЃЌашМгШыЙ§СПЬМЫсМиШмвКЃЌЬМЫсМиКЭТШЛЏБЕЗДгІЩњГЩЬМЫсБЕГСЕэЃЌРызгЗНГЬЪНЮЊCO32-+Ba2+=BaCO3Ё§ЃЛЃЈ4ЃЉвЊГ§ЕєЖргрЕФЬМЫсИљЃЌвЊЕЮМгЪЪСПЕФбЮЫсЃЌЬМЫсИљРызгКЭбЮЫсЗДгІЩњГЩЖўбѕЛЏЬМКЭЫЎЃЌРызгЗНГЬЪНЮЊCO32-+2H+=CO2Ёќ+H2OЁЃ

 ЬНОПгыЙЎЙЬКгФЯПЦбЇММЪѕГіАцЩчЯЕСаД№АИ
ЬНОПгыЙЎЙЬКгФЯПЦбЇММЪѕГіАцЩчЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЬюПеЬт
| ЛьКЯЮя | ЗжРыЛђЬсДПЗНЗЈ |
| ЃЈ1ЃЉГ§ШЅFeЃЈOHЃЉ3НКЬхжаЕФCl- | ______ |
| ЃЈ2ЃЉГ§ШЅввДМШмвКжаЕФNaCl | ______ |
| ЃЈ3ЃЉЗжРыБЅКЭNa2CO3ШмвККЭввЫсввѕЅ | ______ |
| ЃЈ4ЃЉЗжРыЕтКЭNaClЙЬЬх | ______ |
| ЃЈ5ЃЉГ§ШЅCaOжаЕФCaCO3 | ______ |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЬюПеЬт
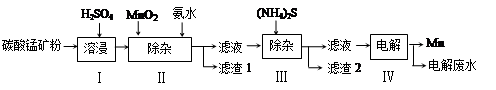
| ЮяжЪ | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1ЁС10-13 | 3.0ЁС10-16 | 5.0ЁС10-16 | 1.0ЁС10-11 | 5.0ЁС10-22 | 1.0ЁС10-22 |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
| AЃЎввДМ | BЃЎБН | CЃЎЫФТШЛЏЬМ | DЃЎжБСѓЦћгЭ |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
 ЁЂCH3CH2OHЁЂCH3CH2BrЁЂNH4ClШмвКЫФжжЮоЩЋвКЬхЃЌжЛгУвЛжжЪдМСОЭФмАб ЫќУЧМјБ№ПЊЃЌетжжЪдМСЪЧ(ЁЁЁЁ)
ЁЂCH3CH2OHЁЂCH3CH2BrЁЂNH4ClШмвКЫФжжЮоЩЋвКЬхЃЌжЛгУвЛжжЪдМСОЭФмАб ЫќУЧМјБ№ПЊЃЌетжжЪдМСЪЧ(ЁЁЁЁ)| AЃЎфхЫЎЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁЁ | BЃЎNaOHШмвК |
| CЃЎNa2SO4ШмвК | DЃЎBr2ЕФCCl4ШмвК |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
| | Юя жЪ | Г§дгЪдМС | ЗжРыЗНЗЈ |
| A | ЯѕЫсЭШмвКЃЈЯѕЫсвјЃЉ | ЭЗл | НсОЇ |
| B | NaClШмвКЃЈCuCl2ЃЉ | NaOHШмвК | нЭШЁ |
| C | ввДМЃЈЫЎЃЉ | ЁЊЁЊ | ЗжвК |
| D | УОЗлЃЈТСЗлЃЉ | NaOHШмвК | Й§ТЫ |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
| AЃЎБНЁЂМКЭщЁЂЫФТШЛЏЬМ | BЃЎБНЁЂввДМЁЂЫФТШЛЏЬМ |
| CЃЎЯѕЛљБНЁЂввДМЁЂЫФТШЛЏЬМ | DЃЎЯѕЛљБНЁЂввДМЁЂввЫс |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЪЕбщЬт
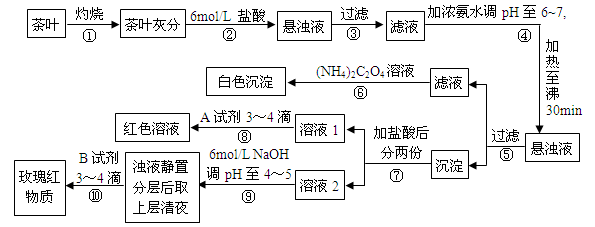
| AЃЎВНжшЂкМгШы6mol/LбЮЫсЕФжївЊФПЕФЪЧЮЊСЫНЋВшвЖЛвЗжжаЕФИЦЁЂЬњЁЂТСФбШмадЛЏКЯЮязЊЛЏЮЊПЩШмадТШЛЏЮя |
| BЃЎВНжшЂнЫљЕУТЫвКжаШмжЪЕФжївЊГЩЗжЮЊЃКCaCl2ЁЂNH3ЁЄH2O |
| CЃЎВНжшЂоПЩвдМьГіИЦдЊЫиДцдкЃЌРызгЗДгІЗНГЬЪНЮЊCa2++C2O42- = CaC2O4Ё§ |
DЃЎВНжшЂржаAЪдМСЮЊKSCNШмвКЃЌРызгЗДгІЗНГЬЪНЮЊFe3++3SCN- Fe(SCN)3 Fe(SCN)3 |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЬюПеЬт

| ЮяжЪ | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1ЁС10Ѓ13 | 3.0ЁС10Ѓ16 | 5.0ЁС10Ѓ16 | 1.0ЁС10Ѓ11 | 5.0ЁС10Ѓ22 | 1.0ЁС10Ѓ22 |
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com