
| A.白醋中滴入石蕊试液呈红色 | B.白醋具有杀菌消毒作用 |
| C.蛋壳浸泡在白醋中有气体放出 | D.pH试纸显示醋酸的pH为2~3 |
科目:高中化学 来源:不详 题型:单选题
| A.配制0.10 mol/L CH3COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 |
| B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 |
| C.对盐酸和醋酸溶液进行导电性实验,若与CH3COOH溶液相串联的灯泡较暗,证明醋酸为弱电解质 |
| D.配制0.10 mol/L CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原氨水的浓度=10-3mol /L |
| B.氨水的电离程度增大,溶液中所有离子的浓度均减小 |
C.溶液中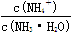 的增大 的增大 |
| D.再加入10mLpH=3的盐酸,混合液pH=7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| KSP或Ka | KSP=1.8×10-10 | KSP=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.①④ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH由小到大的顺序是①< ②< ③< ④ |
| B.溶液中水电离出的H+浓度由小到大的顺序是②<①<④<③ |
| C.取一定体积的④溶液,分别和①、②、③溶液完全中和,消耗①、②、③溶液的体积由小到大的顺序是②<①<③ |
| D.取a体积的①溶液和b体积的④溶液混合后,溶液的pH为3,则a:b约为11:9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | ① | ② | ③ | ④ |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com