
| A、向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C、稀释浓硫酸时应将水沿着烧杯壁慢慢地注入盛有浓硫酸的烧杯中,并不断搅拌 |
| D、浓硫酸能与铜反应,说明浓硫酸有强氧化性 |
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
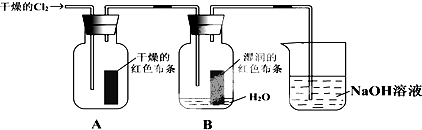
查看答案和解析>>
科目:高中化学 来源: 题型:
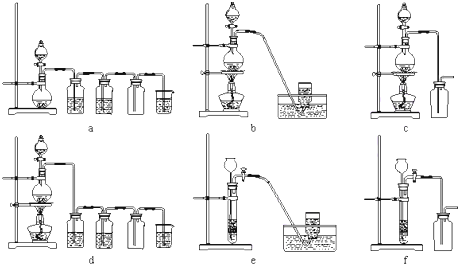
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①④ | B、只有③ |
| C、只有②③ | D、只有①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
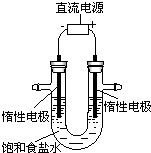 电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集Cl2小于2 L,原因是
电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集Cl2小于2 L,原因是查看答案和解析>>
科目:高中化学 来源: 题型:
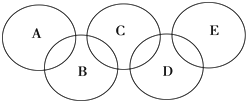 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,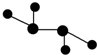 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2,根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2,根据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
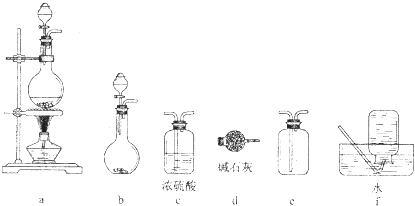
| A、制备收集C2H4:连接a→d→f |
| B、制备收集NO2:连接a→c→f |
| C、制备收集Cl2:连接a→d→e |
| D、制备收集NH3:连接b→→e |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A-B | A═B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com