
| A. | Cu(OH)2 | B. | CuSO4•5H2O | C. | CuSO4 | D. | CuO |
分析 用石墨作电极电解 CuSO4溶液,铜离子未完全放电,电解总反应式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2 ↑+2H2SO4,析出的物质相当于CuO,使电解后溶液恢复至原来状态应加入析出的物质,且能与硫酸反应.
解答 解:用石墨作电极电解 CuSO4溶液,铜离子未完全放电,电解总反应式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2 ↑+2H2SO4,析出的物质相当于CuO,加入适量的CuO可以使电解后溶液恢复至原来状态,加入Cu(OH)2时,与硫酸反应生成水的量比电解时多,而硫酸铜不能与硫酸反应,
故选:D.
点评 本题考查了电解原理,明确阴阳极上析出的物质是解本题关键,从而确定应该加入的物质,加入碳酸铜也可以,可以可作是CuO.CO2,二氧化碳以气体形式逸出,还相当于加入的是CuO.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子核内质子数为15的元素的最高正价为+3 | |
| B. | 电子层数相同时,最外层7个电子的元素非金属性最强 | |
| C. | 原子序数从11依次增加到17,原子半径逐渐增大 | |
| D. | 随着原子序数的增加,元素原子最外层电子数逐渐增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.5mol/(L•min) | B. | υ(B)=1.2mol/(L•s) | C. | υ(C)=1mol/(L•s) | D. | υ(D)=2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
| A. | 反应在前50s的平均速率为v(PCl3)=0.0064mol/(L•s) | |
| B. | 保持其它条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入4molPCl3、4molCl2,达到平衡时,则此反应的化学平衡常数为0.025mol/L | |
| D. | 相同温度下,起始时间向容器中充入2molPCl5、0.40molPCl3和0.40molCl2,达到平衡前v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为负极、Y为正极 | |
| B. | 工作一段时间后,KOH的物质的量不变 | |
| C. | 在标况下通过5.6 L O2完全反应则有l.0 mol 电子发生转移 | |
| D. | 该电池工作时甲烷一极附近溶液 pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
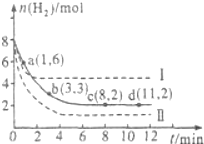 工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都减小,平衡向逆反应方向移动 | |
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的熔沸点比原任一金属要高 | B. | 合金的硬度比原任一金属要大 | ||
| C. | 非金属也可以是合金的成分之一 | D. | 合金的用途比纯金属的用途更广 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com