
【题目】某小组在验证反应“2Fe3+ + Cu =2Fe2+ + Cu2+”的实验中观察到溶液颜色由棕黄色变为浅绿色,且产生灰白色沉淀。发现和探究过程如下。
实验过程 | 实验现象 | |
实验1 |
| 充分振荡,棕黄色溶液逐渐变浅,最后呈浅绿色,有灰白色固体产生 |
实验1中所得溶液的颜色比预期的浅,针对其原因进行探究。
(1)甲认为:实验后,溶液中c (Cu2+)应为0.5 mol/L。“溶液颜色浅”是c (Cu2+)低于0.5 mol/L造成的。 配制含0.5 mol/L CuCl2和____________mol/L FeCl2混合溶液,观察溶液的颜色。该溶液为蓝绿色,明显比实验所得溶液颜色深,说明_________________________。
(2)甲进一步研究认为,“溶液颜色浅”与产生了灰白色固体有关。
甲查阅资料如下,猜想灰白色固体可能含有CuCl。
资料:CuCl是白色固体,不溶于水、硫酸,可溶于氨水。
为探究灰白色固体成分,设计实验方案如下:
方案1 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入过量稀硝酸,如果有白色固体剩余,则证明有CuCl |
方案2 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入浓氨水浸泡,过滤,向滤液中加入稀硫酸 |
a.按方案1进行实验2:
b.加入稀硝酸的目的是___________,反应的离子方程式是____________________________________。
c.乙认为该方案不严谨,理由是:CuCl具有还原性,被硝酸氧化后的生成物能溶于稀硝酸。
d.按方案2进行实验3:
e.加入稀硫酸时,产生的实验现象是____________,说明灰白色固体中含有CuCl。
(3)综合上述实验,说明实验1所得溶液的颜色比预期浅的原因是_____________________________。
【答案】1 溶液颜色比预期的浅,是c (Cu2+)低于0.5 mol/L造成的 除去未反应的铜 3Cu+8H++2NO === 3Cu2++2NO↑+4H2O 产生白色沉淀 在Cl-和足量Cu存在时,由于生成了CuCl,从而使溶液中c (Cu2+)低于0.5 mol/L
【解析】
(1)5ml1 mol/L FeCl3溶液与足量Cu反应,理论上得到0.5 mol/L CuCl2和1 mol/LFeCl2混合溶液,CuCl2与过量的铜反应生成了CuCl,从而使溶液中c (Cu2+)低于0.5 mol/L;
(2)由于CuCl具有还原性,被硝酸氧化后的生成物能溶于稀硝酸没有白色固体剩余,检验白色固体为CuCl,应将洗净的灰白色固体混合物加入浓氨水浸泡,过滤,向滤液中加入稀硫酸,观察是否有白色沉淀生成;
(3)由实验可知,反应中生成的CuCl2与过量的铜反应生成了CuCl,从而使溶液中c (Cu2+)低于0.5 mol/L,CuCl的生成与Cl-和Cu的存在有关。
(1)由方程式可知,5ml1 mol/L FeCl3溶液与足量Cu反应,理论上得到0.5 mol/L CuCl2和1 mol/LFeCl2混合溶液,实验中溶液颜色浅可能是CuCl2发生反应生成CuCl导致c (Cu2+)低于0.5 mol/L,为确认c (Cu2+)低于0.5 mol/L,应该配制含0.5 mol/L CuCl2和1 mol/LFeCl2混合溶液,与实验所得混合液进行颜色对比,若溶液颜色浅,说明溶液中c (Cu2+)低于0.5 mol/L,故答案为:1;溶液颜色比预期的浅,是c (Cu2+)低于0.5 mol/L造成的;
(2)方案1向洗净的灰白色固体混合物加入稀硝酸,过量的铜溶于稀硝酸生成硝酸铜、一氧化氮和水,剩余固体为白色CuCl固体;方案2将洗净的灰白色固体混合物加入浓氨水浸泡,CuCl与浓氨水反应溶解,剩余固体为过量的铜;由于CuCl具有还原性,被硝酸氧化后的生成物能溶于稀硝酸没有白色固体剩余,所以为验证白色固体为CuCl,应向滤液中加入稀硫酸,重新生成白色CuCl固体,说明灰白色固体中含有CuCl,故答案为:除去未反应的铜;3Cu+8H++2NO =3Cu2++2NO↑+4H2O;产生白色沉淀;
(3)由以上实验可知,反应中生成CuCl的原因是CuCl2与过量的铜反应生成了CuCl,从而使溶液中c (Cu2+)低于0.5 mol/L,实验1所得溶液的颜色比预期浅,故答案为:在Cl-和足量Cu存在时,由于生成了CuCl,从而使溶液中c (Cu2+)低于0.5 mol/L。


科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
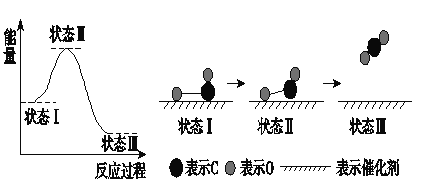
下列说法中正确的是( )
A. CO和O生成了具有共价键的CO2 B. 在该过程中,CO断键形成C和O
C. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 D. CO和O生成CO2是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3OC≡CH+CH3OH+A ![]() CH2=C(CH3)COOCH3,下列说法正确的是
CH2=C(CH3)COOCH3,下列说法正确的是
A. 已知该反应的原子利用率为100%,则A为CO2
B. CH3OH和甘油互为同系物
C. CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D. 能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol/L的AgNO3溶液分别滴定体积均为V0mL的且浓度均为0.1000molL的KCl、KBr及KI溶液,其滴定曲线入下图,(已知25℃时,AgCl、AgBr及AgI溶度积常数依次为l.8×10-10、5.0×10-13、8.3×10-17),下列说法正确的是

A. V0= 45.00
B. 滴定曲线①表示KCl的滴定曲线
C. 滴定KCl时,可加入少量的KI作指示剂
D. 当AgNO3溶液滴定至60.00mL 时,溶液中 c(I-)-)-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.常温下将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1 L溶液。
(1)该溶液中存在的平衡体系有(用离子反应方程式表示)________
(2)溶液中共有________ 种不同的微粒。
(3)这些微粒中浓度为0.01 mol·L-1的是_____,浓度为0.002 mol·L-1的是___。
(4)______和_______两种微粒的物质的量之和比OH-的物质的量多0.008 mol。
II.(5)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的______。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(6)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5 mol·L-1]时溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均为a g,将它们在氧气中完全氧化的产物全部通入到足量的过氧化钠固体中,过氧化钠固体增重为a g,符合条件的物质种类有( )
①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH
A. 4 种 B. 5 种 C. 6种 D. 2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关碱金属的叙述正确的是( )
A.随核电荷数的增加,密度逐渐增大
B.碱金属单质的金属性很强,均易与Cl2、O2、N2等发生反应
C.Cs2CO3加热时不能分解为CO2和Cs2O
D.无水硫酸铯的化学式为Cs2SO4,它不易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知:(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A),3v(C)=2v(B),则此反应可表示为( )
A.2A+3B=2CB.A+3B=CC.3A+B=2CD.A+B=C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com