
【题目】硫酸工业的重要反应之一:2SO2(g)+O2(g)![]() 2SO3(g)下列叙述不正确的是( )
2SO3(g)下列叙述不正确的是( )
A.其他条件不变,升高温度可增大SO3的生成速率
B.使用合适的催化剂,是为了增大化学反应速率
C.该反应达到化学平衡状态时,SO2可100%转化为SO3
D.该反应达到化学平衡状态时,SO3的浓度不再改变
科目:高中化学 来源: 题型:
【题目】用铂电极电解CuSO4和Al2(SO4)3的混合液一段时间后,往溶液中加入0.5mol Cu2(OH)2 CO3恰好使溶液复原,则电解过程转移的电子的物质的量为( )
A.1 molB.2 molC.3 molD.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。写出反应的离子方程式:_______________________。
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温 度(T) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率×10-3mol·L-1·min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是________________________________________________。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是_________________________________________。
II.生活污水中的磷和氮主要以磷酸盐和铵盐形式存在。
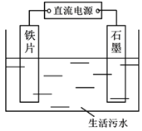
(1)除磷的原理如上图所示,利用电解法将PO43-转化为Fe3(PO4)2沉淀除去。铁作___________,(填“阴极”“阳极”),用化学用语表示产生Fe2+的主要过程:__________________________。
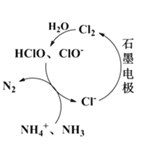
(2)有Cl-存在时,除氮原理如图所示,主要依靠电解产生的有效氯(HClO、ClO-)将NH4+或NH3氧化为N2.当pH<7时,主要发生HClO氧化NH4+的反应,其离子方程式为:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向体积相同、浓度均为0.1 mol/L的MOH、ROH两种碱溶液中不断加水稀释,溶液的pH与溶液浓度的对数(lgc)间的关系如图。下列说法错误的是

A. Kb(MOH)的数量级为10-5
B. a、b两点溶液中,水的电离程度:a<b
C. 等体积等浓度的ROH和MCl混合后所得溶液中:c(OH-)>c(H+)
D. 用相同浓度的盐酸分别中和a、b两点溶液,消耗盐酸体积:Va>Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容积为1L的密闭容器中通入1mol CO2和3mol H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
A. 该反应在高温下才能自发进行
B. 再加入一定量CO2,则n(CH3OH)/n(CO2)减小
C. 温度升高,反应的平衡常数K增大
D. 当CO2和H2转化率相等时,该反应达到化学平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2![]() O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A.CO与HbO2反应的平衡常数K=![]()
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验过程中,下列溶液的导电能力变化不大的是
A. ![]() 溶液中滴入
溶液中滴入![]() 溶液至过量
溶液至过量
B. 醋酸溶液中滴入氨水至过量
C. 澄清石灰水中通入![]() 至过量
至过量
D. ![]() 溶液中加入适量的NaOH固体
溶液中加入适量的NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( )

A.电池反应中有NaCl生成
B.电池的总反应是金属钠还原三价铝离子
C.正极反应为:NiCl2+2e-=Ni+2Cl-
D.钠离子通过钠离子导体在两电极间移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。

A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com