
【题目】以下有关描述正确的个数是( )
①甲苯分子中的所有原子可能共平面 ②苯乙烯![]() 中的所有原子可能共平面
中的所有原子可能共平面
③二氯甲烷分子为正四面体结构 ④乙烷分子中的所有原子不可能都在同一平面内
⑤甲烷分子中的4个氢原子全部被苯基取代 ,其分子内的所有碳原子可能共平面
,其分子内的所有碳原子可能共平面
A. 1 B. 2 C. 3 D. 4
科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业,下图是乙酸苯甲酯的一种合成路线(部分反应物、产物和反应条件略去)。已知A是果实的催熟剂。
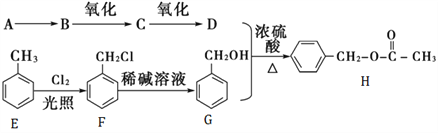
(1)A分子的电子式为________;C的分子式为________;D中官能团结构简式为________。
(2)A→B反应类型为_____________,反应F→G反应类型___________。
(3)G的同分异构体有多种,遇FeCl3溶液显紫色的共有_____种;
苯环上一氯代物有2种的物质的结构简式______________。
(4)写出下列反应的化学方程式:
B→C:_____________________;
F→G:______________________;
G→H:___________________;
C的银镜反应方程式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马日夫盐[Mn(H2PO4)2·2H2O]是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和A l 2O3)为原料制备马日夫盐的流程如下:
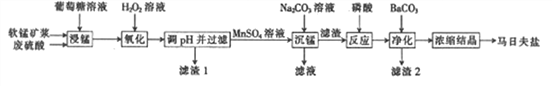
⑴软锰矿要先制成矿浆的目的是______________,葡萄糖(C4H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为___________________。
(2)用H2O2溶液“氧化”时发生反应的离子方程式为_______________________。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表,“调pH并过滤”时,应调整的pH范围为______________,滤渣1的主要成分为____________(填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为_____________________。
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9% ,则1吨该软锰矿可制得马日夫盐________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国早期研制的PEM低压电解臭氧发生器的结构如图。在电解槽里,最中间的是固体电解质聚合膜,膜两边分别是多孔的阳极和多孔的阴极,纯水从两边进人阳极水箱和阴极水箱。下列说法不正确的是
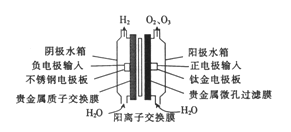
A. 在阳极室发生的反应有2H2O-4e-=4H++O2↑、3H2O-6e-=6H++O3↑
B. 通电时,H+向阴极室移动
C. 相同条件下O2与O3的体积之和小于H2的体积
D. 若用食盐水代替纯水,则对产物成分没有影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】李时珍在《本草纲目》中写到:“烧酒非古法也,白元时始创其法。用浓酒和糟入甑,蒸令气上,用器承取滴露。”文中涉及的操作方法是
A. 蒸馏 B. 升华 C. 萃取 D. 干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )

A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000molL-1NaOH溶液滴定20.00mL0.1000molL-1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用。
(1)已知:3Fe2O3(s)+CO(g)=2Fe3O4(s)+4CO2(g) △H1=-47kJ/mol;
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H2=-14kJ/mol。
则Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=________。
(2)煤化工行业中常常通过研究不同温度下反应的平衡常数来解决各种实际问题。将等体积的CO和H2O(g)通入一恒容密闭容器中,发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
① 该反应的平衡常数表达式K=_______,该反应的正反应是_______(填“吸热”或“放热”)反应。
② 若反应在800℃时进行, CO和H2O(g)的起始浓度均为0.020 mol·L-1,则该条件下,CO的平衡转化率为_________。
③ 下列措施中能够提高CO转化率的是______(填字母)
a.降低温度 b.加入催化剂 c.增加CO的浓度 d.加入H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol·L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示。下列说法不正确的是( )

A. b点pH值大于1 B. 盐酸浓度为 0.lmol·L-1
C. c点:c(Na+)>c(A-)>c(H+)>c(OH-) D. 曲线Ⅰ为盐酸,曲线Ⅱ为醋酸溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com