
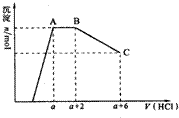
 某10mL溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,向溶液中逐滴加入1mol/L的盐酸,生成沉淀物质的量与加入盐酸体积的关系如图所示,下列说法中正确的是( )
某10mL溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,向溶液中逐滴加入1mol/L的盐酸,生成沉淀物质的量与加入盐酸体积的关系如图所示,下列说法中正确的是( )| A、原溶液肯定含有OH-,CO32-,AlO2-,SiO32-,Na+ | ||
B、若原溶液中只含有某一种阳离子(不考虑水电离出引厂来的氢离子)且忽略反应前后溶液体积变化,那么该离子在原溶液中的物质的量浓度为
| ||
| C、n(CO32-):n(AlO2-)=3:4 | ||
| D、a值肯定等于4 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一价金属和一元酸 | B、二价金属和二元酸 | C、三价金属和二元酸 | D、二价金属和一元酸 |
查看答案和解析>>
科目:高中化学 来源:华中师大第一附属中学2006-2007学年度部分学校高三化学起点调研测试卷 题型:022
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)某无色溶液中可能含有NH4+、K+、Al3+、HCO3—、Cl—、MnO4—、SO42—等离子中的几种离子。
①经实验可知溶液明显呈酸性,且焰色反应呈现出紫色。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。
③另取少量该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解。
(1)该溶液中一定不含有 (填离子的化学式)离子,一定含有的离子有 (填离子的化学式);
(2)在这些不存在的离子中,有一种离子在酸性环境中和碱性环境中都不能存在,试写出该离子与酸反应的离子方程式: ;
(3)为确定上述溶液中所含的各种离子的物质的量,取100mL上述溶液并向其中加入Na2O2固体,产生的沉淀和气体与所加Na2O2固体物质的量的关系曲线如图Ⅰ:
 |
①该溶液中焰色反应呈现紫色的离子的物质的量为: mol,
②写出n(Na2O2)=0.2mol时反应的总离子方程式: ;
(4)将0.1mol明矾晶体与等物质的量的某无水盐晶体X混合后溶解于水中,所得溶液与上述溶液所含离子种类完全相同。若向该溶液中加入Ba(OH)2溶液,所得沉淀的物质的量与所加入Ba(OH)2的物质的量的关系如图Ⅱ:
 |
试根据图像推断①X的化学式: ,②图像中A点溶液中的离子成分和物质的量分别是: ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com