
| A. | 标准状况下,22.4 L HF含有的分子数为 NA | |
| B. | 28 g N2和N4组成的混合气体中含有的原子数为2 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 5.6 gFe在0.1moCl2中充分燃烧,转移的电子数目为0.3NA |
分析 A.标准状况下HF的状态不是气态;
B.N2和N4都只含有N原子,根据n=$\frac{m}{M}$计算出混合物中含有N原子的物质的量,从而可得出含有原子数;
C.缺少溶液体积,无法计算溶液中含有氯离子的数目;
D.先判断不足量,根据不足量计算出转移电子的物质的量及数目.
解答 解:A.标准状况下,HF不是气体,不能使用标准状况下的气体摩尔体积计算,故A错误;
B.28 g N2和N4组成的混合气体中含有28 gN,含有N原子的物质的量为:$\frac{28g}{14g/mol}$=2mol,所以混合气体中含有的原子数为2NA,故B正确;
C.没有告诉1 mol•L-1A1Cl3溶液的体积,无法计算含有氯离子的物质的量,故C错误;
D.5.6gFe的物质的量为0.1mol,0.1molFe完全反应消耗0.15mol氯气,氯气不足,0.1mol氯气与Fe完全反应转移0.2mol电子,转移的电子数目为0.2NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的应用,题目难度不大,明确标准状况下气体摩尔体积的使用条件为解答关键,注意熟练掌握物质的量与其它物理量之间的转化关系,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 少量的NaHCO3逐滴加入Ba(OH)2溶液中:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→CO32-+2C6H5OH | |
| D. | 向100 mL 3mol•L-1FeBr2溶液中通入标准状况下 3.36 LCl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
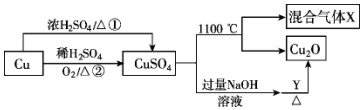
| A. | 相对于途径①,途径②更好地体现了绿色化学思想 | |
| B. | 硫酸铜在1100℃分解所得气体X可能是二氧化硫和三氧化硫的混合气体 | |
| C. | Y可以是葡萄糖溶液 | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶可制得胆矾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 两种互不相溶的液体,如汽油和水,可通过分液方法分离 | |
| B. | 因为碘易溶于酒精,所以常用酒精萃取碘水中的碘 | |
| C. | 观察钾元素焰色反应的操作:先将铂丝放在稀硫酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的外焰上进行灼烧,透过蓝色钴玻璃进行观察 | |
| D. | 将饱和FeCl3溶液滴入沸水中可得Fe(OH)3胶体,区别溶液和胶体的方法是丁达尔效应 | |
| E. | 分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗上口倒出上层液体 | |
| F. | 向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 | |
| G. | 为除粗盐中的可溶性杂质,先加氯化钡后加碳酸钠,最后加盐酸后过滤 | |
| H. | 在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{\;}$SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
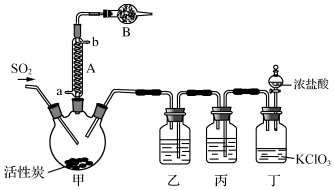
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | W克该原子的物质的量一定是$\frac{W}{a{N}_{A}}$ mol | |
| C. | W克该原子中含有$\frac{W}{b}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{12}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取5.85gNaCl | |
| B. | 用广泛pH试纸测得橙汁pH为3.50 | |
| C. | 用酸式滴定管量取25.00 mL高锰酸钾溶液 | |
| D. | 用酸性高锰酸钾溶液检验FeCl3中是否含有FeC12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式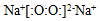 | |
| B. | CO2的电子式: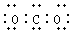 | |
| C. | ${\;}_{53}^{127}$I和${\;}_{53}^{129}$I2互为同位素 | |
| D. | 硫离子的结构示意图: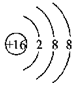 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com