
向100mL的FeBr2溶液中,通入标准状况下Cl2 5.04L,Cl2全部被还原,测得溶液中c(Br-)=c(Cl-),则原FeBr2溶液的物质的量浓度是
A.0.75mol/L B.1.5mol/L C.2mol/L D.3mol/L
科目:高中化学 来源: 题型:
下图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”,下列有关doggycene的说法正确的是( )
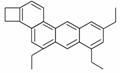
A.“doggycene”中所有碳原子不可能处于同一平面上
B.该物质的分子式为C26H30
C.常温下该有机物为气态
D.1 mol该物质在氧气中完全燃烧生成CO2和H2O的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如下图:

已知烧结过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等
(1)写出烧结过程中铝元素转化的化学方程式 。
(2)操作a为冷却、研磨,其中研磨的目的是 。
(3)浸出过程中,NaFeO2可完全水解,水解反应的离子方程式为 。
(4)操作b的名称是 ,所用的玻璃仪器有 、 和烧杯。
(5)“碳化”时生成沉淀,沉淀的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)电镀是将镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层。
①若用铜盐进行化学镀铜,应选用 (填“氧化剂”或“还原剂”)与之反应。
②某化学镀铜的反应速率随镀液pH变化如右图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法: 。
(3)酸浸法制取硫酸铜的流程示意图如下:
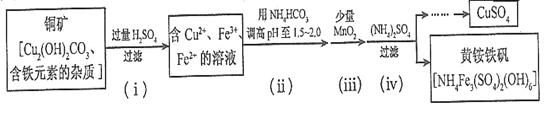
①步骤(i)中Cu2(OH)2CO3发生反应的化学方程式为 。
②步骤(ii)所加试剂起调节pH作用的离子是 (填离子符号)。
③在步骤(iii)发生的反应中,1molMnO2转移2 mol电子,该反应的离子方程式为:
。
④步骤(iv)除去杂质的化学方程式可表示为
3Fe3++NH4++2SO42-+6H2O=NH4Fe3(SO4)2(OH)6↓+6H+,过滤后母液的pH=2.0,
c(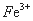 )=a mol·L—1,c(
)=a mol·L—1,c(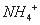 )=b mol·L—1,c(
)=b mol·L—1,c(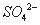 )=d mol·L—1,
)=d mol·L—1,
该反应的平衡常数K= (用含a、b、d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X和Y是两种单质,X+Y→X2++Y2- ,现有下列叙述正确的是: ①X被氧化 ②X是氧化剂 ③Y2-是还原产物 ④X2+具有氧化性 ⑤Y2-具有还原性 ⑥Y单质氧化性比X2+氧化性强
A.①②③ B.①②⑥ C.①③④⑤⑥ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
将35.8 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44 LNO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
A. 66.4 g B.50.8 g C 44.8g D. 39.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
从海带中提取碘,可经过以下实验步骤完成,下列有关说法正确的是

A.在灼烧过程中使用的仪器有酒精灯、三脚架、泥三角、烧杯、玻璃棒
B.在上述氧化过程中发生的离子方程式为:2I-+H2O2 = I2 + 2OH-
C.在提取碘单质时,用酒精作萃取剂
D.在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3·5H2O俗称“海波”,是常用的脱氯剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20 ℃和70 ℃时的溶解度分别为60.0 g和212 g,Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解。下面是实验室制备及相关性质实验。
制备海波的反应原理:Na2S O3+S
O3+S Na
Na 2S2O3
2S2O3
制备海波的流程:

(1)实验开始时 用1 mL乙
用1 mL乙 醇润湿硫粉的作用是 。
醇润湿硫粉的作用是 。
A.有利于亚硫酸钠与硫黄的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是 。
(3)滤液不采用直接蒸发结晶的可能原因是  。
。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是 。
A.无水乙醇 B.饱和NaCl溶液
C. 水 D.滤液
水 D.滤液
(5)产品的纯度测定:取所得产品10.0 g,配成500 mL溶液,再从中取出25 mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050 mol·L-1的标准碘水 溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定化学方程式:
溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定化学方程式:
I2+2Na2S2O3 2NaI+Na2S4O6
2NaI+Na2S4O6
产品中的Na2S2O3·5H2O的纯度为 %。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com