
(13分)如右图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由_______________逐渐变为_______色,试管内的液面会逐渐_____________,剩余气体约占试管容积的__________,用化学方程式表示这种变化__________________________;上述反应停止后向试管中缓慢通入氧气,气体颜色又由______色逐渐变为____________色,之后又变为______色,继续通入氧气,直到试管中充满液体为止,用一个化学方程式表示试管中发生的化学反应_____________________________________。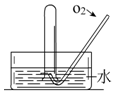
科目:高中化学 来源: 题型:阅读理解
 锌锰干电池是最早使用的化学电池,其基本构造如图所示.
锌锰干电池是最早使用的化学电池,其基本构造如图所示.| 实验步骤 | 实验现象 | 实验结论和解释 | ||||||||
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, 白色沉淀消失, 白色沉淀消失, 产生有刺激性气味的气体 产生有刺激性气味的气体 |
无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 NH4++OH-
NH4++OH-
|

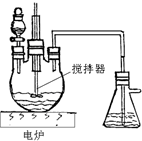
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 |
MnO2做氧化剂,生成Mn2+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2012届江西省重点中学高三第二次联考理综化学试卷(带解析) 题型:填空题
(14分)(1)二氧化硫的催化氧化的过程如图所示,
其中a、c二步的化学方程式可表示为:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 温度/℃ | 0.1[ | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |

 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。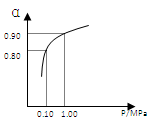
查看答案和解析>>
科目:高中化学 来源:2011-2012年四川省成都市六校协作体高二上学期期中考试化学试卷 题型:选择题
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的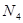 分子。
分子。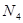 分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ。
分子结构如右图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ。

根据以上信息和数据,下列说法正确的是( )
A.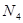 属于一种新型的化合物 B.
属于一种新型的化合物 B.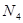 与
与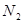 互为同素异形体
互为同素异形体
C.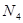 沸点比
沸点比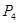 (白磷)高
D.1mo1
(白磷)高
D.1mo1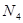 气体转变为
气体转变为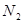 将吸收882kJ热量
将吸收882kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com