
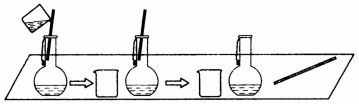
分析 (1)根据所给的仪器来选择试剂;
(2)用固体配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀,据此选择需要仪器;
(3)任何操作导致实验失败且无法补救的,都必须重新配制;
(4)玻璃棒移出后直接放在桌面上,造成残留洗涤液损失,导致溶质的物质的量偏小,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)用固体来配制大约1mol•L-1的溶液100mL,需要的仪器是托盘天平、带刻度的烧杯、玻璃棒,用浓溶液来配制大约1mol•L-1的溶液100mL,需要的仪器是量筒、带刻度的烧杯、玻璃棒,故从所提供的仪器看,abcd的溶液均可配制,
故选:abcd;
(2)用食盐晶体配制1mol•L-1的氯化钠溶液250mL,步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀,需要仪器:托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以必须用到的仪器是②③④⑤;
故答案为:②③④⑤;
(3)用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,导致实验失败,无法补救,必须重新配制;
故选:④;
(4)玻璃棒移出后直接放在桌面上,造成残留洗涤液损失,导致溶质的物质的量偏小,依据C=$\frac{n}{V}$可知溶液浓度偏低,
故答案为:偏低;玻璃棒移出后直接放在桌面上,造成残留洗涤液损失.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①② | C. | ①③ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取所需的浓盐酸时仰视读数 | |
| B. | 用量筒量取的浓盐酸时,量筒里有少许蒸馏水 | |
| C. | 定容时,仰视标线 | |
| D. | 定容后倒转容量瓶数次摇匀,发现液面最低点低于标线,再补加几滴蒸馏水至标线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g | B. | 9g | C. | 12g | D. | 13.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1+Q2+Q3 | B. | 0.5Q3-Q2+2Q1 | C. | Q3-2Q2+4Q1 | D. | 0.5(Q1+Q2+Q3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广燃煤发电,同时将化工厂迁移至人口稠密的地区 | |
| B. | 加强生活污水的脱氮除磷处理,遏制水体的富营养化 | |
| C. | 加强汽车尾气的处理,减少大气污染物的排放 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
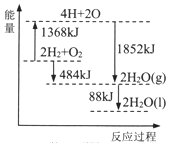
| A. | 拆开2molH2(g)和1 molO2(g)中的化学键,共放出1368 kJ能量 | |
| B. | 1 molH2和0.5molO2的能量之和比1 molH2O(1)的能量大242 kJ | |
| C. | 2H2O(g)=2H2(g)+O2(g)△H=+484KJ/mol | |
| D. | 2H2(g)+O2(g)=2H2O(1)△H=572KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com