
下列各表述与示意图一致的是( )
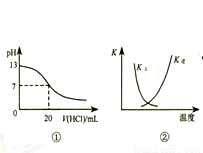
A.图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化
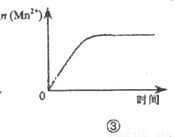
B.图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化
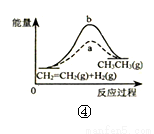
C.图③表示10 mL 0.0l mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化
科目:高中化学 来源:2016届山东省高三上学期12月质检化学试卷(解析版) 题型:选择题
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH CH3COO-+H+ K1=1.75×10-5△H1>0
CH3COO-+H+ K1=1.75×10-5△H1>0
CH3COO-+H2O CH3COOH+OH- K2=5.71×10-10△H2>0
CH3COOH+OH- K2=5.71×10-10△H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,则下列叙述正确的是
A.对混合溶液进行微热,K1增大、K2减小
B.混合溶液的pH>7
C.温度不变,若在混合溶液中加入少量NaOH固体,则c(CH3COO-)减小
D.混合溶液中c(CH3COO-)>c(Na+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中(理)化学试卷(解析版) 题型:选择题
下列有关离子浓度的比较正确的是
A.0.1mol•L-1氨水中,c(OH-)<c(NH4+)
D.0.1mol•L-1某二元弱酸碱性NaHA溶液中,c(H+)+c(H2A)═c(A2-)+c(OH-)
B.10mL 0.02mol•L-1HCl溶液与10mL 0.02mol•L-1Ba(OH)2溶液充分混合,c(Cl-)>c(Ba2+)>c(OH-)=c(H+)
C.将0.1mol•L-1CH3COONa和0.1mol•L-1NH4Cl等体积混合后的溶液中,c(H+)+c(CH3COOH)>c(NH3•H2O)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
某模拟“人工树 叶”电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
叶”电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
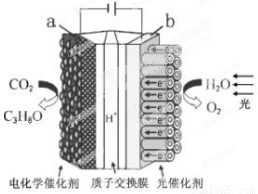
A.该装置工作时,b极发生还原反应
B.每生成1 mol O2,有44 g CO2被还原
C.该装置工作时,H+从a极区通过质子交换膜向b极区迁移
D.a电极的反应为:3CO2 + 18H++18e-= C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上12月月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.氨水与稀盐酸反应:H+ + OH- = H2O
B.FeCl3溶液与铁反应:Fe3+ + Fe = 2Fe2+
C.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.KOH稀溶液中通入过量的SO2:SO2+OH-=HSO3-
查看答案和解析>>
科目:高中化学 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:实验题
Ⅰ.下列实验操作中,叙述正确的是 (填字母)
A.用pH试纸测定溶液的pH时,若先用蒸馏水润湿试纸一定会导致测定结果偏小
B.过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌
C.分液时,分液漏斗中下层液体从下口放出后再将上层液体从下口放出到另—烧杯
D.做焰色反应的铂丝,用硫酸洗涤后,再在酒精灯火焰上灼烧至无色,才可使用
E.向溶液中加盐酸酸化的BaCl2 ,如果产生白色沉淀,则一定有SO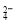
F.证明某盐中含有NH4+的方法是:取该盐加入强碱溶液加热,如果产生使湿润的蓝色石蕊试纸变红的气体,便证明有NH4+
G.使用容量瓶配置一定浓度的溶液时,俯视刻度线定容后所得溶液的浓度偏高
H.用灼烧法鉴别棉织品和毛织品,有焦臭味的是毛织品
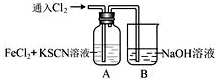
Ⅱ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
(1)B中反应的离子方程式是 .
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在________ .
(3)资料显示:SCN -的电子式为 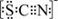 .甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN﹣中被氧化的元素是 .
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高一上期中测试化学试卷(解析版) 题型:填空题
在一个氧化还原反应中,氧化剂和还原剂转移的电子数应该相等。已知Na2SO3是一个具有还原性的盐。KMnO4是一个具有强氧化性的盐,易被还原为无色的Mn2+。两种物质均广泛用于工业合成上,回答下列问题。
(1)将Na2SO3溶液加入盛有下列溶液的试管中,试管内产生明显现象的是________
a.BaCl2溶液 b.淀粉碘化钾溶液 c.高锰酸钾溶液 d.NaOH溶液
(2)为了增强KMnO4溶液的酸性,实验室常在该溶液中加入一种酸,该酸是______
(3)KMnO4和亚铁离子在酸性条件下可得到Fe3+,且2Fe3++2I—=2Fe2++I2。在含1molKMnO4的溶液中加入2molFeI2固体,所得产物n(I2):n(Fe3+)为________
(4)工业合成中所用的Na2SO3固体中常含有Na2SO4和Na2CO3杂质,为测定固体中Na2SO3的含量,某兴趣小组设计以下三种方案,可行的一种是_______(填字母),利用该可行方案,所测的Na2SO3的质量分数为____________________。
a 方案:称量固体30g,溶于足量稀硝酸中,完全反应后,加入过量BaCl2溶液,充分反应后静置后,过滤、洗涤沉淀、干燥、称得沉淀质量为6.99g。
b 方案:称量固体30g,溶于足量稀盐酸中,产生的气体通入含0.1molKMnO4的酸性溶液,反应后再加入0.05mol的H2O2时,KMnO4的溶液恰好褪为无色。
c 方案:称量固体30g,溶于足量稀硫酸中,产生的气体全部被足量的澄清石灰水吸收,完全反应后,石灰水溶液增重6.4g。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:选择题
知X、Y、Z、W四种短周期非稀有气体元素在周期表中的相对位置如图所示,下列说法正确的是( )

A. Z的原子序数不可能是X的原子序数的2倍
B. Z元素的原子半径可能比Y元素的小
C. W的气态氢化物的稳定性一定比Y的强
D. Z的最高价氧化物的水化物的酸性一定比W的强
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列实验操作正确的是

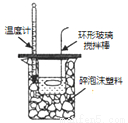
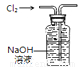
A.称NaOH固体的质量 B.读数为10.60 C.反应热的测定 D.收集氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com