
| A、常温下,pH小于7 |
| B、存在关系式:c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| C、25℃时,由水电离产生的c(H+)>1×10-7mol?L-1 |
| D、向溶液中加入少量NaOH固体,c(S2-)增大 |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:

| A、电流从锌电极经金属导线流向铜电极 |
| B、锌为阴极,铜为阳极 |
| C、负极的电极反应式为:Zn-2e→Zn2+ |
| D、一段时间后,溶液中阳离子总浓度增大、阴离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液和NaAlO2溶液混合会放出CO2 |
| B、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C、能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| D、AlCl3溶液和NaAlO2溶液加热蒸干、灼烧都得到Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①中烧杯内中加入黄色的K3[Fe(CN)6]溶液,一段时间后看不到Fe电极附近有蓝色沉淀生成,该装置可看作金属的析氢腐蚀 |
| B、装置②盐桥中的Cl-向硫酸铜溶液移动 |
| C、装置③中外电路电流方向:b极→a极 |
| D、装置④中阳极反应:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物.高空中的飘尘在大气中可形成胶体 |
| B、自来水厂用明矾KAl(SO4)2?12H2O对天然水进行消毒、杀菌,可使硬水变软水 |
| C、自行车钢架生锈主要是电化学腐蚀所致 |
| D、洪涝、地震灾区灾后可用熟石灰消毒,是利用熟石灰可使蛋白质发生变质的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯能使溴水和酸性KMnO4溶液褪色 |
| B、体积分数为75%的酒精溶液会使细菌蛋白质变性 |
| C、1mol甲烷和1mol氯气在光照条件下充分反应,生成1mol CH3Cl |
| D、CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
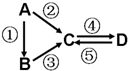 Ⅰ;现有如下物质:①酒精、②铜、③氢氧化钡、④氨气、⑤蔗糖、⑥高氯酸、⑦碳酸氢钠、⑧磷酸、⑨硫化氢、⑩Al2(SO4)3.请用物质的序号填写下列空白:
Ⅰ;现有如下物质:①酒精、②铜、③氢氧化钡、④氨气、⑤蔗糖、⑥高氯酸、⑦碳酸氢钠、⑧磷酸、⑨硫化氢、⑩Al2(SO4)3.请用物质的序号填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
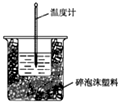 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com