
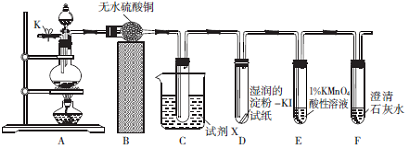
分析 探究实验,连接装置,检查装置的气密性,然后装药品,实验开始,打开开关K,通过导管向装置内通入氮气,排出装置内的空气,防止其对NO的检验的干扰,装置A:碳单质和浓硝酸加热反应生成二氧化氮、二氧化碳和水,反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,装置B:无水硫酸铜和水反应生成蓝色五水合硫酸铜,证明生成的气体中有水蒸气,同时吸收气体中的水蒸气,装置C:NO2的沸点低,试剂X是冰水,收集二氧化氮,装置D:检验二氧化氮是否已全部除去,装置E:检验NO,5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,酸性高锰酸钾颜色慢慢褪去,装置F:检验二氧化碳,最后尾气处理.
(1)NO易被氧气氧化成二氧化氮,探究浓硝酸与木炭反应是否还有NO生成,需排尽装置中的空气;
(2)利用无水硫酸铜和水反应生成蓝色五水合硫酸铜,证明生成的气体中有水蒸气,同时吸收气体中的水蒸气,而无水CaCl2只能干燥气体;装置C用于检验、收集并除去NO2,装置为向上排气法,需利用二氧化氮的沸点低选择X成分;装置D中盛放的是淀粉碘化钾,若有氧化性的二氧化氮剩余,会氧化碘离子生成碘单质,碘单质与淀粉作用显示蓝色,所以D的作用为检验二氧化氮是否已全部除去;
(3)NO具有还原性,高锰酸根离子具有氧化性,两者反应生成硝酸根离子、+2价锰离子,装置A中为碳和浓硝酸反应,生成二氧化氮、二氧化碳、水,因为二氧化碳与酸性高锰酸钾溶液不反应,NO与石灰水不反应若装置E、F中的试剂对调,能达到预期的实验目的;
(4)将等物质的量的NO2、NO混合后通入低温下的水中发生价态归中反应生成亚硝酸,证明亚硝酸与碳酸的酸性相对强弱,可利用强酸制弱酸的原理,或比较等物质的量浓度的亚硝酸盐溶液的PH等角度设计实验.
解答 解:(1)根据实验的目的,验证浓硝酸与木炭反应时有NO2、CO2生成,并探究是否还有NO生成,NO易被氧气氧化成二氧化氮,所以需用与NO不反应的气体,排尽装置中的氧气,所以实验开始,打开开关K,通过导管向装置内通入氮气,
故答案为:排出装置内的空气,防止其对NO的检验的干扰;
(2)无水CaCl2只能干燥气体,无明显现象,无水硫酸铜为白色粉末,无水硫酸铜和水反应生成蓝色五水合硫酸铜,证明生成的气体中有水蒸气,同时吸收气体中的水蒸气;NO2的沸点为21.1℃,沸点低易液化,装置C为向上排气法,X成分为冰水,用于冷却、收集并除去NO2,装置D中盛放的是淀粉碘化钾,若有氧化性的二氧化氮剩余,会氧化碘离子生成碘单质,碘单质与淀粉作用显示蓝色,所以D的作用为检验二氧化氮是否已全部除去,
故答案为:可判断水蒸气是否全部被吸收;冰水;检验二氧化氮是否已全部除去;
(3)在酸性溶液中,NO可将MnO4-还原为Mn2+,NO氧化生成NO3-,反应中元素的化合价变化为 NO→NO3-,氮元素由+2价→+5价,化合价升高3价;MnO4-→Mn2+,锰元素由+7价→+2价,化合价降低5价,所以其最小公倍数为15,故NO的系数为5,高锰酸根离子的系数为3,其它元素根据原子守恒配平,所以反应的离子方程式为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,碳单质和浓硝酸加热反应生成二氧化氮、二氧化碳和水,反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,因为二氧化碳不具有还原性,与酸性高锰酸钾溶液不反应,NO与石灰水不反应,若装置E、F中的试剂对调,能达到预期的实验目的,
故答案为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;能;因为二氧化碳与酸性高锰酸钾溶液不反应,NO与石灰水不反应;
(4)将等物质的量的NO2、NO混合后通入低温下的水中发生价态归中反应,反应方程式为:NO2+NO+H2O=2HNO2,证明亚硝酸与碳酸的酸性相对强弱,可利用强酸制弱酸的原理,
向装有碳酸氢钠的试管里滴加亚硝酸溶液,若有气泡产生,则亚硝酸的酸性相对较强,若无气泡产生,则亚硝酸的酸性相对较弱,或比较等物质的量浓度的亚硝酸盐溶液的PH,比较等物质的量浓度的亚硝酸钠溶液、碳酸氢钠溶液的PH大小,PH小的,对应的酸的酸性相对较强,
故答案为:向装有碳酸氢钠的试管里滴加亚硝酸溶液,若有气泡产生,则亚硝酸的酸性相对较强,若无气泡产生,则亚硝酸的酸性相对较弱,或比较等物质的量浓度的亚硝酸钠溶液、碳酸氢钠溶液的PH大小,PH小的,对应的酸的酸性相对较强.
点评 本题考查了浓硝酸与木炭反应产物的检验,侧重考查实验过程分析,物质性质的实验探究,明确物质性质和实验操作的目的和实验步骤分析是解题关键,注意结合题给信息解答,题目难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | NH${\;}_{4}^{+}$→NH3 | B. | S→S2- | C. | HCl→Cl2 | D. | CO32-→CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
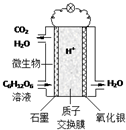 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 电池工作时,H+向石墨电极移动 | |
| B. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| C. | 石墨电极上反应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| D. | 该电池每转移4mol电子,石墨电极产生33.6LCO2气体(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体密度保持不变 | |
| B. | 单位时间内生成n mol A,同时生成3n mol B | |
| C. | 混合气体的压强保持不变 | |
| D. | C生成的速率与A分解的速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 且X、Y 均为不大于20的正整数,据此回答下列问题:
且X、Y 均为不大于20的正整数,据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com