
| A. | 偏铝酸钠溶液:K+、NO3-、NH3•H2O | |
| B. | 空气:C2H6、CO2、SO2、NO | |
| C. | 硫酸铜溶液:H+、K+、S2-、Br- | |
| D. | 重铬酸钾钾溶液:H+、Na+、SO42-、乙醛分子 |
科目:高中化学 来源: 题型:多选题
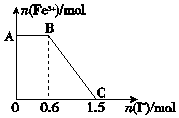 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 | |
| C. | 开始加入的K2Cr2O7为0.15 mol | |
| D. | K2Cr2O7与FeSO4反应的物质的量之比为1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每种烃的含氧衍生物中至少有3种元素 | |
| B. | 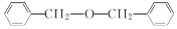 中含有的官能团为醚基 中含有的官能团为醚基 | |
| C. | 所有的有机物中都含有碳,多数含氢,其次还含有氧、氮、卤素、硫、磷等 | |
| D. | 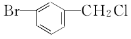 属于芳香卤代烃 属于芳香卤代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有关物质的转化关系如图所示,固体X由两种常见元素组成,其中一种为常见金属元素,另一种为非金属元素,且质量比为14:1,B是常见的无色无味气体,可以使澄清石灰水变浑浊,C是一种红棕色气体,D是最常见的无色液体,E溶液遇硫氰化钾溶液显血红色,F是紫红色的金属单质,I是常见的无色气体,遇空气变为红棕色.
有关物质的转化关系如图所示,固体X由两种常见元素组成,其中一种为常见金属元素,另一种为非金属元素,且质量比为14:1,B是常见的无色无味气体,可以使澄清石灰水变浑浊,C是一种红棕色气体,D是最常见的无色液体,E溶液遇硫氰化钾溶液显血红色,F是紫红色的金属单质,I是常见的无色气体,遇空气变为红棕色. 
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者的pH比后者的大 | 元素非金属性:S>C |
| B | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液,试管口出现红棕色气体 | 溶液中NO被Fe2+还原为NO2 |
| C | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色 | Fe2+的还原性强于Br- |
| D | 向溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀 | 溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 4:1 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
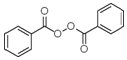 也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程:
也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程: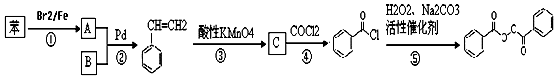
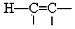 $\stackrel{Pd}{→}$
$\stackrel{Pd}{→}$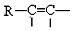
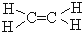 ;
;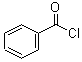 +H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$
+H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$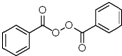 +2HCl;
+2HCl;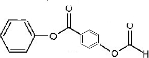 、
、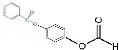 ;
; ;
; 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com