【答案】
分析:(1)加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气,根据元素化合价是否变化确定盐酸的作用,注意浓盐酸和二氧化锰反应生成氯气,但稀盐酸和二氧化锰不反应;
(2)氯气有毒,但能和强碱反应;
(3)氯气和氢氧化钙反应生成氯化钙、次氯酸钙;
(4)根据题意知,降低温度即可;氢氧化钙能和氯化氢反应生成氯化钙.
解答:解:(1)①加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气,反应方程式为:MnO
2+4HCl(浓)
MnCl
2+2H
2O+Cl
2↑;
②该反应中,部分氯元素化合价升高,部分化合价不变,所以盐酸有还原性和酸性,故选ac;
③浓盐酸和二氧化锰反应生成氯气,但稀盐酸和二氧化锰不反应,且参加反应的盐酸有一半参加氧化还原反应,所以若有0.4molHCl参加反应,可制得氯气2.24L,故选C;
故答案为:MnO
2+4HCl(浓)
MnCl
2+2H
2O+Cl
2↑;ac;C;
(2)氯气有毒不能直接排空,但氯气能和氢氧化钠反应生成无毒物质,所以D中试剂是氢氧化钠溶液,
故答案为:NaOH溶液,吸收氯气等尾气,防止污染环境;
(3)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应方程式为:2Cl
2+2Ca(OH)
2=Ca(ClO)
2+CaCl
2+2H
2O,故答案为:2Cl
2+2Ca(OH)
2=Ca(ClO)
2+CaCl
2+2H
2O;
(4)①温度较高时氯气与消石灰反应生成了Ca(ClO
3)
2,为避免副反应发生,应该降低温度,所以可以采取将U型管置于冷水浴中的措施,
故答案为:将U型管置于冷水浴中;
②盐酸易挥发,加热过程中生成的氯气中含有氯化氢,氯化氢能和碱反应,所以反应方程式为:Ca(OH)
2+2HCl=CaCl
2+2H
2O,为避免副反应发生,可以在B、C之间连接一个盛有饱和食盐水的洗气瓶,
故答案为:Ca(OH)
2+2HCl=CaCl
2+2H
2O;在B、C之间连接一个盛有饱和食盐水的洗气瓶.
点评:本题考查了氯气的实验室制法、尾气的处理等知识点,注意浓盐酸和二氧化锰反应但稀盐酸不和二氧化锰反应,为易错点.


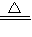 MnCl2+2H2O+Cl2↑;
MnCl2+2H2O+Cl2↑;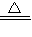 MnCl2+2H2O+Cl2↑;ac;C;
MnCl2+2H2O+Cl2↑;ac;C;

 名校课堂系列答案
名校课堂系列答案
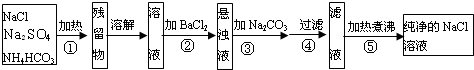
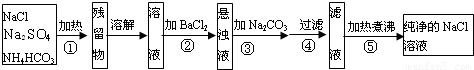
 某学生设计如图所示实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应,反应后温度将升高),A中盛浓盐酸,C中盛潮湿的消石灰,据此回答下列问题:
某学生设计如图所示实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应,反应后温度将升高),A中盛浓盐酸,C中盛潮湿的消石灰,据此回答下列问题: