
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 容器甲中的反应在前2min的平均速率v(SO2)=0.05mol•L-1•min-1 | |
| B. | 达到平衡时,容器丙中正反应速率与容器甲相等 | |
| C. | 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0 | |
| D. | 容器乙中若起始时改充0.10mol•L-1NO2和0.20mol•L-1SO2,达到平衡时c(NO)与原平衡不相同 |
分析 甲经2min达平衡时,NO2的转化率为50%,其平衡浓度为:0.10mol/L×50%=0.05mol/L,则:
NO2(g)+SO2(g)?SO3(g)+NO(g)
开始(mol/L):0.1 0.1 0 0
转化(mol/L):0.05 0.05 0.05 0.05
平衡(mol/L):0.05 0.05 0.05 0.05
故该温度下平衡常数K=$\frac{0.05×0.05}{0.05×0.05}$=1,各容器内温度相同,平衡常数均相同,
A.根据v=$\frac{△c}{△t}$计算容器甲中的反应在前2min的平均速率;
B.该反应为气体体积不变的反应,压强不影响平衡,则容器甲与容器丙互为等效平衡,结合容器容积相等分析;
C.升高温度后平衡常数增大,则正反应为吸热反应;
D.设平衡时NO的浓度为ymol/L,该稳定性平衡常数K=1,然后利用化学平衡三段式列式计算.
解答 解:甲经2min达平衡时,NO2的转化率为50%,其平衡浓度为0.05mol/L,则:
NO2(g)+SO2(g)?SO3(g)+NO(g)
开始(mol/L):0.1 0.1 0 0
转化(mol/L):0.05 0.05 0.05 0.05
平衡(mol/L):0.05 0.05 0.05 0.05
故该温度下平衡常数K=$\frac{0.05×0.05}{0.05×0.05}$=1,
A.容器甲中的反应在前2min的平均速率v(SO2)=$\frac{0.05mol/L}{2min}$=0.025mol•L-1•min-1,故A错误;
B.反应 NO2(g)+SO2(g)?SO3(g)+NO(g)为气体体积不变的反应,压强不影响平衡,则容器甲和丙互为等效平衡,平衡时反应物转化率相等,由于丙中各组分浓度为甲的2倍,则容器丙中的反应速率较大,故B错误;
C.温度升至90℃,上述反应平衡常数为1.56>1,则升高温度平衡向正反应方向移动,则正反应为吸热反应,该反应的△H>0,故C正确;
D.设平衡时NO的浓度为ymol/L,则:
NO2(g)+SO2(g)?SO3(g)+NO(g)
开始(mol/L):0.1 0.2 0 0
转化(mol/L):y y y y
平衡(mol/L):0.1-y 0.2-y y y
则:$\frac{y×y}{(0.1-y)×(0.2-y)}$=1,说明容器乙中若起始时改充0.10mol•L-1NO2和0.20mol•L-1SO2时,平衡时NO的浓度相同,故D错误;
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡常数、反应速率的概念及表达式为解答关键,注意掌握三段式在化学平衡计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 用BaCl2溶液鉴别Na2CO3和Na2SO4溶液 | |
| B. | 用淀粉溶液检验食盐中是否添加KIO3 | |
| C. | 用焰色反应并透过蓝色钴玻璃检验NaCl中是否混有KCl | |
| D. | 用溴水鉴别乙烯和二氧化硫两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
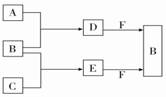 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )| A. | F中阴阳离子个数比为1:1 | |
| B. | 化合物F中既有离子键又有共价键 | |
| C. | 合成过程中的反应均是氧化还原反应 | |
| D. | 1mol F与E反应时转移的电子数为NA(NA为阿伏伽德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
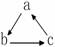 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | HNO2 | CH2=CH2 | NaOH | Fe |
| b | NO | CH3CH2Br | NaHCO3 | FeCl3 |
| c | NO2 | CH3CH2OH | Na2CO3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
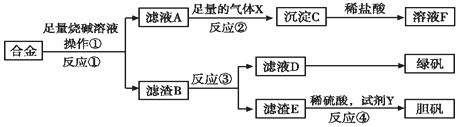
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | 4.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
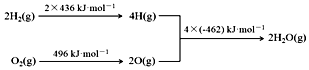
| A. | C(s)+H2O(g)═CO(g)+H2(g)△H=+130 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-480 kJ•mol-1 | |
| C. | C(s)燃烧热为110 kJ•mol-1 | |
| D. | 欲分解2 mol H2O(l),至少需要提供480kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO全部转化为乙醇 | |
| B. | 断4NA个H-H键的同时,生成46g乙醇 | |
| C. | 若反应在恒温密闭容器中进行,容器中混合气体的密度不再改变 | |
| D. | 若反应在绝热密闭容器中进行,容器中温度不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯中 C=C 的键能是乙烷中 C-C 的键能的 2 倍 | |
| B. | 同一原子中,2p,3p,4p 能级的轨道数目依次增多 | |
| C. | C-O 键的极性比 N-O 键的极性大 | |
| D. | 根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的水解反应又叫皂化反应 | |
| B. | 分子式为C5H12O的醇类有5种结构 | |
| C. | 乙醇发生氧化反应生成乙酸,乙酸和乙醇发生取代反应生成乙酸乙酯 | |
| D. | 有机物甲的分子式为C3H6,则甲与乙烯(C2H4)互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com