
| A. | CCl4和SiCl4的熔点 | |
| B. | 邻羟基苯甲醛( )和对羟基苯甲醛( )和对羟基苯甲醛(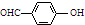 )的沸点 )的沸点 | |
| C. | HF和HCl在水中的溶解度 | |
| D. | H2SO3和H2SO4的酸性 |
分析 A.结构相似的分子晶体,相对分子质量越大分之间作用力越强,熔点越高;
B.根据氢键对物理性质的影响分析,形成分子间的氢键时沸点较高,形成分子内的氢键时沸点较低;
C.HF与水分子之间能形成氢键,氢键的存在能增强物质的溶解性;
D.同一元素的含氧酸,中心元素化合价越高,酸性越强.
解答 解:A.CCl4和SiCl4都是结构相似的分子晶体,四氯化硅的相对分子量大于四氯化碳,所以熔点后者高,故A不选;
B.邻羟基苯甲醛(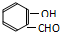 )能形成分子内氢键,对羟基苯甲醛(
)能形成分子内氢键,对羟基苯甲醛(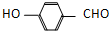 )能形成分子间氢键,形成分子间的氢键时沸点较高,形成分子内的氢键时沸点较低,所以邻羟基苯甲醛的熔点低于对羟基苯甲醛,故B不选;
)能形成分子间氢键,形成分子间的氢键时沸点较高,形成分子内的氢键时沸点较低,所以邻羟基苯甲醛的熔点低于对羟基苯甲醛,故B不选;
C.HF与水分子之间能形成氢键,氢键的存在能增强物质的溶解性,所以HF和HCl在水中HF的溶解度大,故C选;
D.H2SO3和H2SO4中硫酸中硫为+6价,亚硫酸中硫为+4价,所以硫酸酸性强于亚硫酸,故D不选;
故选:C.
点评 本题考查物质的物理性质,熟悉影响物质熔沸点、溶解性因素,明确同一元素的含氧酸酸性强弱比较方法是解题关键,题目难度中等.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极:2H++2e-═H2↑阳极:4OH--4e-═O2↑+2H2O | |
| B. | 阴极:Cu2++2e-═Cu 阳极:4OH--4e-═O2↑+2H2O | |
| C. | 阴极:2H++2e-═H2↑ 阳极:2Cl--2e-═Cl2↑ | |
| D. | 阴极:Cu2++2e-═Cu 阳极:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 试验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同系物不一定符合同一通式 | |
| B. | 同分异构体不一定具有相同的最简式 | |
| C. | 相对分子质量相等的两种有机物必定是同分异构体 | |
| D. | 同分异构体间不一定有相似的化学性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com