
(1)下列物质中,可形成酸雨的是______。
A.二氧化硫 B.氟氯代烃
C.二氧化碳 D.甲烷
(2)现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理;②少用原煤作燃料;③燃煤时鼓入足量空气;④开发清洁能源。其中能减少酸雨产生的措施是______。
A.①②③ B.②③④
C.①②④ D.①③④
科目:高中化学 来源: 题型:
实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
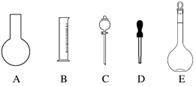
(1)如图所示的仪器中配制溶液肯定不需要的是________________________________________________________________________
(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________(填“>”、“<”或“=”)0.1 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“>”、“<”或“=”)0.1 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________(计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
非晶体指内部微粒排列呈现杂乱无章的分布状态的固体。下列关于非晶体的叙述中,错误的是( )
A.是物质的一种聚集状态 B.内部微粒的排列是长程无序和短程有序的
C.非晶体材料的所有性能都优于晶体材料 D.金属形成的合金也有非晶体的
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期律是20世纪科学技术发展的重要理论依据之一。已知A、B、C、D、E五种元素都是元素周期表中前20号元素,A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水,E元素原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族。

根据以上信息,回答下列问题:
(1)上述五种元素中电负性最大的是________。(填相关元素的元素符号)
(2)请写出D的电子排布式:____________________________。
(3)A和D的氢化物中,沸点较高的是________(填相关物质的分子式);其原因是
____________________________________。
(4)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物的化学式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。表中对实验现象的描述或解释不正确的是( )

| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸是中学化学实验室的常见药品,其性质有①酸性 ②吸水性 ③脱水性 ④强氧化性 ⑤催化作用,请将序号填在相应的横线上:
(1)锌和稀H2SO4制H2________;
(2)浓硫酸作干燥剂________;
(3)浓硫酸与蔗糖的炭化实验(黑面包实验)________;
(4)实验室用乙醇和冰醋酸制取乙酸乙酯________;
(5)乙酸乙酯的水解________;
(6)纤维素的水解________;
(7)浓硫酸与铜的反应________;
(8)浓硫酸使湿润石蕊试纸变红,后来又变黑________。
查看答案和解析>>
科目:高中化学 来源: 题型:
脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是____________________________ 。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO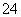 、Br-、HCO
、Br-、HCO 等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:

①向曝气池中通入空气的目的是______________________________________________。
②通入空气后,曝气池中的海水与天然海水相比,浓度有明显不同的离子是______(填字母)。
a.Cl- b.SO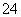 c.Br- d.HCO
c.Br- d.HCO
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)

①图中a极连接电源的______(填“正”或“负”)极,C口流出的物质是________。
②SO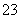 放电的电极反应为________________________。
放电的电极反应为________________________。
③电解过程中阴极区碱性明显增强,用平衡移动的原理解释碱性增强的原因:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中几种常见物质的转化关系如下图(部分产物未列出)。A是一种金属单质,D是一种非金属固体单质。

请回答下列问题:
(1)A、C的化学式分别为A__________,C__________。
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是________(填字母)。
A.C+2H2SO4(浓)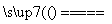 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Fe+H2SO4===FeSO4+H2↑
C.Cu+2H2SO4(浓)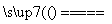 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.FeO+H2SO4===FeSO4+H2O
(3)写出反应E+H2O2—→F的化学方程式:__________________________________。
(4)若反应F+D—→E转移电子数为6.02×1023,则消耗D的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NO吸收治疗法可快速改善SARS重症患者的缺氧状况,缓解病情,病毒学研究同时证实,NO对SARS病毒有直接抑制作用。下列关于NO的叙述正确的是( )
A.NO是一种红棕色气体
B.常温常压下,NO不能与空气中的氧气直接化合
C.含等质量的氧元素的NO和CO的质量相等
D.NO难溶于水,可以用排水法收集
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com