
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题:
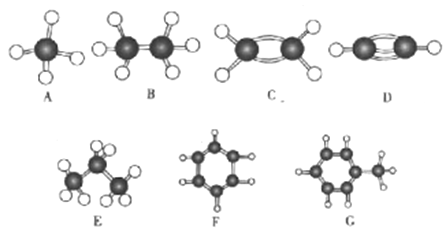
(1)常温下含氢质量分数最高的气态烃是______(填字母)。
(2)写出E失去一个氢原子后所得烃基的结构筒式:______________。
(3)一卤代物种类最多的是_______(填字母)。
(4)写出实验室制取D的化学方程式:________________。
(5)写出F发生硝化反应的化学方程式:__________________。
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数的电子数之和。下列说法不正确的是
![]()
A. 最简单的氢化物的沸点:X>W
B. 元素的非金属性:Z>W>Y
C. 简单离子的半径大小:Y>W>Z
D. 氧化物对应水化物的酸性:Y<W<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)E在周期表中的位置为第_____周期第_____族;
(2)B元素形成的最高价氧化物的化学式为_____;
(3)化合物D2C2中所含的化学键类型是_____;
(4)元素C、D、E形成的简单离子半径大小关系是_____(用离子符号表示);
(5)由A、B、C三种元素形成的离子化合物的化学式为_____,它与强碱溶液共热,发生反应的离子方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的混合溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )

A.线段Ⅱ表示Br-的变化情况
B.原溶液中n(FeI2):n(FeBr2)=3:1
C.根据图像无法计算a的值
D.线段Ⅳ表示HIO3的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是最早记载丹砂的药用价值和炼制方法的,为了使人民重视丹砂,我国曾发行面值为10分的丹砂邮票。汞单质及其化合物在工业生产和科学研究上有着广泛用途。丹砂炼汞的反应原理包括以下两个反应:
反应I:HgS+O2![]() Hg+SO2
Hg+SO2
反应II:4HgS+4CaO![]() 4Hg+3CaS+CaSO4
4Hg+3CaS+CaSO4
(1)反应I中,还原产物是______,每生成1个SO2分子,转移电子数为______。
(2)反应II中,HgS是________(填“氧化剂”、“还原剂”或“氧化剂和还原剂”),用双线桥法标出反应II中电子转移的方向和数目。________
4HgS+4CaO![]() 4Hg+3CaS+CaSO4
4Hg+3CaS+CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-,回答下列问题:
H++B2-,回答下列问题:
(1)NaHB溶液显___(填“酸性”、“中性”或“碱性”或“无法确定”),理由是_______。
(2)某温度下,向0.1 mol·L-1 的NaHB溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________(填序号)。
a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=c(HB-)+2c(B2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知0.1 mol·L-1NaHB溶液的pH=2,则0.1 mol·L-1H2B溶液中氢离子的物质的量浓度可能是________0.11 mol·L-1(填“<”、“>”或“=”); 理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计一个甲醚燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)写出负极的电极反应式_____________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____(填“增大”、“ 减小”或“不变”)。
(4)若在标准状况下,有2.24L氧气参加反应,则丙装置中阴极析出铜的质量为______。假设乙装置中氯化钠溶液足够多,若在标准状况下,有224mL氧气参加反应,则乙装置中阳离子交换膜左侧溶液质量将____________(填“增大”、“减小”或“不变”),且变化了_______克。
(5)若将乙装置中铁电极与石墨电极位置互换,其他装置不变,此时乙装置中发生的总反应式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的冶炼过程大致如下:![]() 富集:将方铅矿
富集:将方铅矿![]() 进行浮选;
进行浮选;![]() 焙烧:
焙烧:![]()
![]()
![]() ;
;![]() 制粗铅:
制粗铅:![]()
![]()
![]() ,
,![]()
![]()
![]() 。下列说法正确的是:
。下列说法正确的是:
A.浮选法富集方铅矿的过程发生化学变化
B.将![]() 冶炼成Pb理论上至少需要
冶炼成Pb理论上至少需要![]()
C.整个冶炼过程中,制取![]() 共转移
共转移![]() 电子
电子
D.方铅矿焙烧的反应中,PbS是还原剂,还原产物只有PbO
查看答案和解析>>
科目:高中化学 来源: 题型:
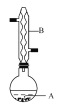
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]() +
+![]()
![]()
![]() +H2O
+H2O
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
乙酸 | 60 | 1.049 2 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50 min,反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液 和水 洗涤,分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)仪器B的名称是________,它的作用是____________________。
(2)在洗涤操作中,第一次水洗的主要目是___________________________
第二次水洗的主要目的是_______________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后____(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是_____________________________。
(5)实验中加入少量无水MgSO4的目的是___________________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是____(填标号)。
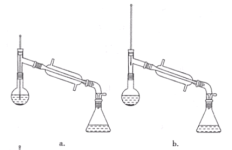
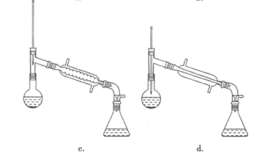
(7)本实验的产率是____(填标号)。
a.30% b.40% c. 60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏____(填“高”或“低”),其原因是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com