
科目:高中化学 来源: 题型:
A~F均为中学化学中常见的物质,它们之间相互转化的关系如下图所示(产物水等略去)
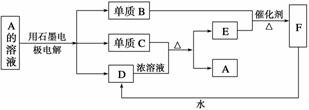
(1)写出下列物质的化学式:A__________,D__________,F________。
(2)C和D的稀溶液不反应,但若B与C反应后再与D反应可生成A,试写出有关反应方程式:________________________________________________________________。
(3)写出A的溶液电解时阳极的电极反应方程式:_______________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
丰富多彩的材料使我们的生活更美好。
⑴生产硅酸盐水泥和普通玻璃都用到的主要原料是 (填名称)。
⑵生活中有大量的铝制品。家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。
⑶鉴别真假羊毛衫的方法是先取样,再_____ _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,下列说法正确的是
A.常温常压下,11.2 L氮气所含的原子数目为NA
B.NA个甲烷分子和1mol甲烷的质量相等
C.2 L 1 mol·L-1的盐酸中所含氯化氢分子数约为2NA
D.常温下,0.05 mol CO和SO2混合气体中所含氧原子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学帮助水质检测站配制1000mL 1 mol·L-1NaOH溶液以备使用。
(1)该同学应选择___________mL的容量瓶。
(2)其操作步骤如下图所示,则如图操作应在下图中的 (填选项字母)之间。
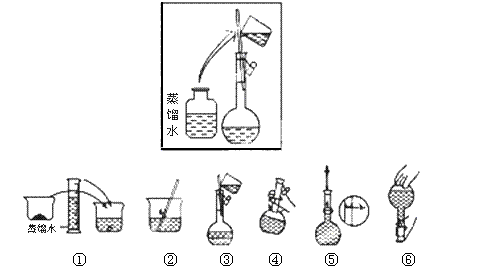 |
A.②与③ B.①与② C.④与⑤
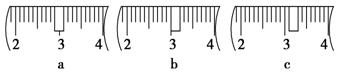
(3)该同学应用托盘天平称取NaOH固体 g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项 (填选项字母)。
(4)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视读数,浓度会 ;
②转移溶液过程中,少量液体溅出来,浓度会 ;
③容量瓶未干燥,浓度会 ;
④定容摇匀后发现溶液凹面低于刻度线,浓度会 。
(5)配制溶液的实际操作过程中,动作要快,否则由于 ,会使配制的NaOH溶液的浓度比1 mol·L-1 (填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表1信息,判断以下叙述正确的是( )
表1 部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固 体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
A.Mg和Al的总质量为8g
B.硫酸的物质的量浓度为5 mol/L
C.生成的H2在标准状况下的体积为11.2L
D.NaOH溶液的物质的量浓度为5mol/L
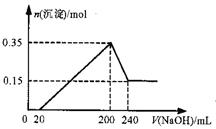
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应3A(g)+B(g) C(s)+4D(g) ΔH<0,
C(s)+4D(g) ΔH<0,
右图中a、b表示一定条件下,D的体积分数随时间t的变化
情况。若要使曲线b变为曲线a,可采取的措施是( )
①增大B的浓度 ②升高反应温度
③缩小反应容器的体积(加压) ④加入催化剂
A.①② B.①③ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
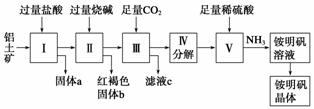
请回答下列问题:
(1)固体a的化学式为________,Ⅲ中通入足量CO2气体发生反应的离子方程式为________________________________________________________________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
 (3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84 g·cm-3)________ L(保留一位小数)。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84 g·cm-3)________ L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com