
| A、电池的电解质溶液为碱性溶液,正极为Ni2O3、负极为Fe |
| B、电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C、电池放电过程中,溶液中的OH-向负极移动 |
| D、电池放电与充电过程发生的化学反应是可逆反应 |


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
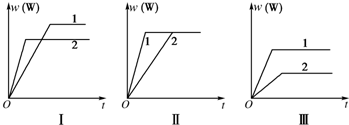
| A、图Ⅰ可能是不同压强对反应的影响,且p1>p2,a+b<n |
| B、图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b |
| C、图Ⅱ可能是在同温同压下不同催化剂对反应的影响,且1使用的催化剂效果好 |
| D、图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
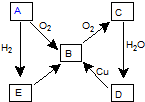 图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去).
图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向A1C13溶液中加过量NaOH溶液 |
| B、向NaAlO2溶液中加过量盐酸 |
| C、向KOH溶液中加过量的Al2(S04)3溶液 |
| D、向BaCl2溶液中通人少量CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
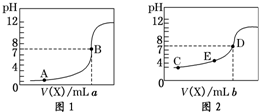
| A、图2是滴定盐酸的曲线 |
| B、a与b的关系是:a<b |
| C、E点对应离子浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、这两次滴定都可以用甲基橙作为指示剂且颜色变化为红变橙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| H+ |
| 转化 |
2- 7 |
| Fe2+ |
| 还原 |
| OH- |
| 沉淀 |
| 10 |
| 11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com