
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(SO![]() )=c(NH
)=c(NH![]() )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
B.pH=2的HNO3溶液与pH=12的NH3·H2O溶液等体积混合:
c(NH![]() )+c(H+)=c(OH-)+c(NO
)+c(H+)=c(OH-)+c(NO![]() )
)
C.浓度均为0.1 mol/L的Na2CO3与NaHCO3混合溶液:
c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(OH-)
)>c(OH-)
D.0.1 mol/L NaHS溶液:c(OH-)=c(H+)+2c(H2S)+c(HS-)
【答案】BC
【解析】
试题分析:A.1L0.1molL-1(NH4)2Fe(SO4)2溶液中铵根离子浓度大于亚铁离子浓度水解显酸性得到溶液中离子浓度大小为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故A错误;B.pH=2的HNO3溶液与pH=12的NH3·H2O溶液等体积混合的溶液里存在的电荷守恒式为c(NH![]() )+c(H+)=c(OH-)+c(NO
)+c(H+)=c(OH-)+c(NO![]() ),故B正确;C.浓度均为0.1 mol/L的Na2CO3与NaHCO3混合溶液,因CO32-的水解程度大于HCO3-,则c(Na+)>c(HCO
),故B正确;C.浓度均为0.1 mol/L的Na2CO3与NaHCO3混合溶液,因CO32-的水解程度大于HCO3-,则c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(OH-),故C正确;D.0.1 mol/L NaHS溶液存在的电离荷守恒式为c(OH-)+c(HS-)+2c(S2-)=c(H+)+ c(Na+),物料守恒式为c(Na+)=(H2S)+c(HS-)+c(S2-),则c(OH-)=c(H+)+c(H2S)-c(S2-),故D错误;答案为BC。
)>c(OH-),故C正确;D.0.1 mol/L NaHS溶液存在的电离荷守恒式为c(OH-)+c(HS-)+2c(S2-)=c(H+)+ c(Na+),物料守恒式为c(Na+)=(H2S)+c(HS-)+c(S2-),则c(OH-)=c(H+)+c(H2S)-c(S2-),故D错误;答案为BC。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在,钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面,锂混杂于其中。从废料中回收氧化钴(CoO)工艺流程如下:
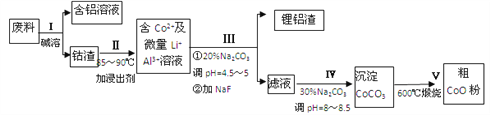
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为________
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为 (产物中只有一种酸根)_________________
在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用 盐酸,请从氧化还原和环境保护的角度分析不用盐酸浸出钴的主要原因是____________________
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式__________________
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl、S、P为三种原子序数相连的元素,则下列说法正确的是( )
A. 气态氢化物的稳定性:HCl>H2S>PH3
B. 非金属活泼性:S<Cl<P
C. 原子半径:Cl>S>P
D. 原子序数:S<P<Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,溶液中能发生如下反应:
①2R-+Z2=R2+2Z-
②16H++10Z-+2XO4-=2X2++5Z2+8H2O
③2M2++R2=2M3++2R-。由此判断,下列说法中正确的是
A.Z2+2M2+=2M3++2Z-不可以进行
B.Z元素在①②反应中发生还原反应
C.各粒子还原性由强到弱的顺序是X2+>Z->R->M2+
D.各粒子氧化性由强到弱的顺序是XO![]() >Z2>R2>M3+
>Z2>R2>M3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A.c1:c2=1:3B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为3:2D.c1的取值范围为0<c1<0.14mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶气体一定具有相同的
A. 质量 B. 密度 C. 碳原子数 D. 原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与盐类水解无关的是
A. 粗盐在空气中易潮解 B. NH4Cl与ZnCl2用于金属焊接中除锈
C. 用热纯碱溶液去油污 D. 蒸干并灼烧FeCl3溶液得到Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
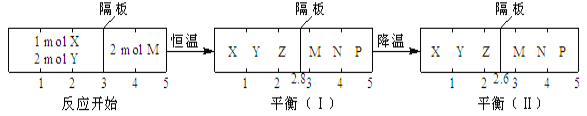
下列判断正确的是( )
A. 反应①的正反应是吸热反应
B. 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C. 达平衡(I)时,X的转化率为5/11
D. 在平衡(I)和平衡(II)中,M在隔板右边气体中的体积分数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com