
 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol?L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol?L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )| A、AB段发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ |
| B、E点对应横坐标稀硫酸的体积为70 mL |
| C、D点表示的沉淀的化学式为Al(OH)3、BaSO4 |
| D、E点沉淀比A点沉淀质量大2.33g |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
| 物质 | 干燥效率 | 物质 | 干燥效率 |
| MgO | 0.008 | ZnCl2 | 0.8 |
| CaO | 0.2 | ZnBr2 | 1.1 |
| A、MgO的干燥性能比CaO好 |
| B、干燥效率可能与干燥剂的阴、阳离子的半径大小有关 |
| C、MgCl2可能是比CaCl2更好的干燥剂 |
| D、上述干燥剂中阳离子对干燥剂性能的影响比阴离子小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
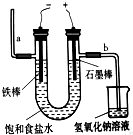
| A、通电一段时间后,与正极相连的电极周围的溶液能使酚酞变红 |
| B、与正极相连的电极上有氢气生成 |
| C、与负极相连的电极上有氯气生成 |
| D、为避免电解产物之间发生反应,常用石棉膜或离子交换膜将电解槽分隔成两部分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol?L-1) | 0.8 | 1.24 | 1.24 |
| A、①②④⑤ | B、②⑥ |
| C、②③④⑥ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为
| ||
| B、100 mL 0.1 mol/L CH3COOH溶液跟足量锌反应,生成的氢气分子数为0.01 NA | ||
| C、0.1 mol CH4所含质子数为NA | ||
| D、0.5mol C2H4中含有的C=C双键数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、②④ | D、③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com