
【题目】用 In 表示元素的第 n 电离能,则图中的 a、b、c 分别代表( )

A.a 为 I1、b 为 I2、c 为 I3B.a 为 I3、b 为 I2、c 为 I1
C.a 为 I2、b 为 I3、c 为 I1D.a 为 I1、b 为 I3、c 为 I2
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某元素R的原子核外电子数等于核内中子数,2.8 g该元素(设其相对原子质量与R原子的质量数相等)的单质R与氧气充分反应,可得到6.0 g化合物RO2,则下列有关说法错误的是( )
A.该元素原子的质子数为13
B.该元素原子的中子数为14
C.该元素原子的最外层电子数为4
D.该元素原子具有3个电子层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的初中化学中的一些重要实验,请回答下列问题:
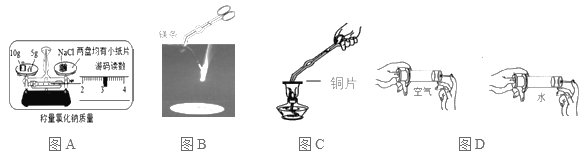
(1)图A称量NaCl的实际质量是___。
(2)图B反应的实验现象是__。
(3)图C反应的表达式为__。
(4)图D实验目的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )的下列叙述中,完全正确的是( )
)的下列叙述中,完全正确的是( )
①能使酸性KMnO4溶液褪色;②可发生加聚反应;③难溶于水;④可溶于苯中;
⑤苯环能与溴水发生取代反应;⑥所有的原子可能共面,且最多有5个原子共线。
A.①②④B.②④⑥C.①②③④D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是第三周期主族元素(11~17号)某些性质变化趋势的柱形图,下列有关说法中正确的是( )
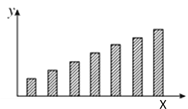
A. 若X轴为原子序数,y轴表示的可能是第一电离能
B. 若X轴为原子序数,y轴表示的可能是原子半径
C. 若X轴为最高正化合价,y轴表示的可能是电负性
D. 若X轴为族序数,y轴表示的可能是0.1mol/L最高价氧化物对应水化物溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g)![]() M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
A. 0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1
B. 当容器中混合气体密度不变时达到平衡状态
C. 平衡后升高温度,X的反应速率降低
D. 到达平衡状态时,反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | — | 315 | — |
熔点/℃ | -70.0 | — | — | — |
升华温度/℃ | — | 180 | 300 | 162 |
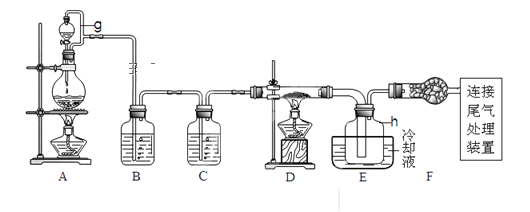
请回答下列问题:
(1)写出装置A中发生反应的离子方程式___。
(2)装置A中g管的作用是___;装置C中的试剂是___;装置E中的h瓶需要冷却理由是___。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质。为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+。
①写出用KMnO4滴定Fe2+的离子方程式:___;
②滴定前是否要滴加指示剂?___(填“是”或“否”),判断滴定终点的方法是___。
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.1mol![]() 气体通入体积为lL的恒容密闭容器中,立即出现红棕色。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法错误的是
气体通入体积为lL的恒容密闭容器中,立即出现红棕色。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法错误的是
A. 压缩容器,颜色加深
B. 在平衡时体系内含![]() 0.04mol
0.04mol
C. 以![]() 的浓度变化表示的平均反应速率为0.001mol/(L·s)
的浓度变化表示的平均反应速率为0.001mol/(L·s)
D. 平衡时,如果再充入一定量![]() ,则可提高
,则可提高![]() 的转化率
的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为8000C时A、B、C三种气体在密闭容器中反应时浓度的变化只从图上分析不能得出的结论是( )

A.A是反应物
B.前2 min A的分解速率为0.1molL-1min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.达平衡后,若增大压强,平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com