
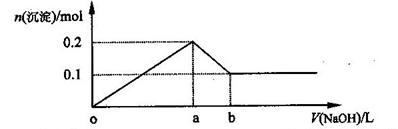
| A.NaOH的浓度为0.6 mol/L | B.在a点处溶液中的溶质为NaCl |
| C.在b点处溶液中的溶质只有NaAlO2 | D.图中线段oa : ab=5 : 1 |
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 测定生成气体的体积
测定生成气体的体积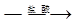 测定生成气体的体积
测定生成气体的体积 溶液
溶液
 称量灼烧产物的质量。
称量灼烧产物的质量。
 溶液时,生成沉淀的质量与加入
溶液时,生成沉淀的质量与加入 溶液体积的关系可用数轴关系表示:
溶液体积的关系可用数轴关系表示: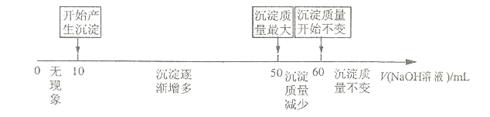
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.⑤③①②④⑥⑦ | B.②③①⑤④⑦⑥ |
| C.②④①③⑦⑤⑥ | D.⑤③①④②⑦⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
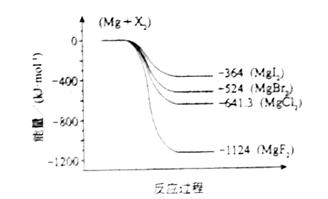
 HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- + H+ Ka1(H2CO3) = 4.45×10-7  CO32- + H+ Ka2(H2CO3) = 5.61×10-11
CO32- + H+ Ka2(H2CO3) = 5.61×10-11 H+ + ClO- Ka(HClO) = 2.95×10-8
H+ + ClO- Ka(HClO) = 2.95×10-8查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
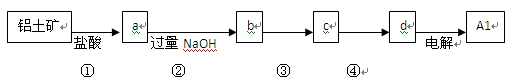
| A.①、②中除加试剂外。还需要进行过滤操作 |
| B.a 、b中铝元素的化合价相同 |
| C.③中需要通入过量的氨气 |
| D.④进行的操作是加热,而且d 一定是氧化铝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,铝和浓硫酸、浓硝酸不反应。 |
| B.两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应生成的氢气前者多。 |
| C.合金的熔点一般比组成的金属成分的熔点都低 |
| D.用酒精灯加热一小片铝箔,熔化的铝会滴落 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝的氧化物粉末是白色的,属于两性氧化物;铁、铜的最高价氧化物粉末都是黑色的,属于碱性氧化物 |
| B.铝制品、铁制品、铜制品长期放置在空气中均易腐蚀 |
| C.制备AlCl3、FeCl3、CuCl2均能采用单质与氯气反应的方法 |
| D.常温下Cu、Fe、Al均不能和浓硫酸发生化学反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com