
【题目】下列说法正确的是
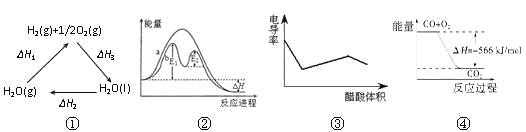
A.图①中△H1=△H2+△H3
B.图②在催化剂条件下,反应的活化能等于E1+E2
C.图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线
D.图④可表示由CO(g)生成CO2(g)的反应过程和能量关系
【答案】C
【解析】
A项,根据盖斯定律可知△H3=-(△H1+△H2),则△H1=-(△H3+△H2),故A项错误;
B项,因为E1>E2图②在催化剂条件下,反应的活化能等于E1,故B项错误;
C项,NaOH 和氨水混合溶液滴入醋酸,NaOH先与醋酸反应生成醋酸钠,氢氧化钠与醋酸钠均为强电解质且离子带电荷数相同,但加入醋酸溶液体积增大,单位体积内电荷数目减少,故溶液导电能力减弱;当氢氧化钠反应完毕后再滴加醋酸,氨水与醋酸反应生成醋酸铵,醋酸铵为强电解质,一水合氨为弱电解质,故随着醋酸滴入溶液导电能力逐渐增强,当氨水反应完后加入醋酸,溶液体积增大,故溶液导电能力逐渐减小,故C项正确;
D项,图④只表示由CO(g)生成CO2(g)的能量变化,并不能表示具体的反应过程,故D项错误。
本题选C。


科目:高中化学 来源: 题型:
【题目】多奈哌齐可用于治疗阿尔茨海默病,中间体L的合成路线如下:
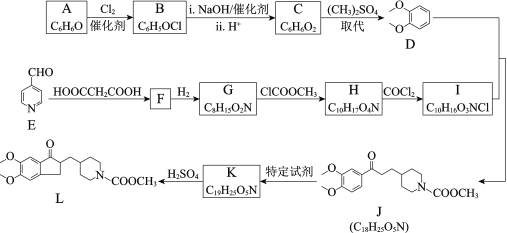
已知:ⅰ.R1—CHO![]() R1—CH=CH—COOH
R1—CH=CH—COOH
ⅱ.![]()
ⅲ.![]()
(1)A中所含官能团的名称是______。
(2)A→B的化学方程式是______。
(3)芳香化合物X是D的同分异构体,符合下列条件的X的结构简式是______。
①核磁共振氢谱有3组吸收峰,峰面积比为1∶2∶2
②1 mol X与足量的金属钠反应,可生成1 mol H2
(4)实验室检验E中含氧官能团的试剂及现象为______。
(5)1 mol F生成1 mol G需要消耗______mol H2。
(6)G→H的反应类型是______。
(7)K的结构简式是______。
(8)由L可通过如下过程合成多奈哌齐:

试剂a的结构简式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应①是制备SiH4的一种方法,利用其副产物可制备相应物质,有关转化关系如下:
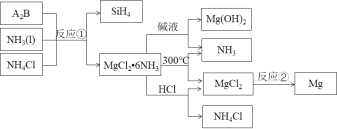
下列说法不正确的是( )
A.A2B的化学式为Mg2Si
B.NH3、NH4Cl可以循环使用
C.反应①中参加反应的NH3和NH4Cl的物质的量之比为1∶1
D.反应②中每生成24gMg转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:
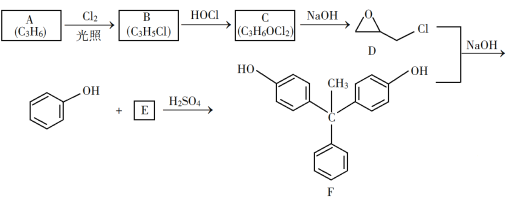
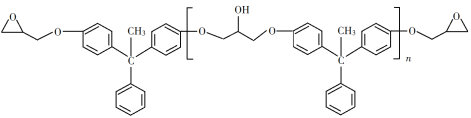
已知以下信息:
①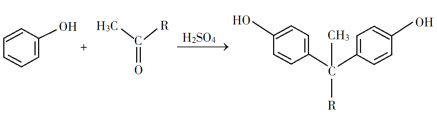 +H2O
+H2O
②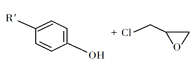 +NaOH
+NaOH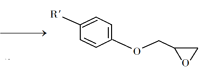 +NaCl+H2O
+NaCl+H2O
③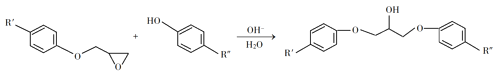
回答下列问题:
(1)A是一种烯烃,化学名称为_____,C中官能团的名称为_____、____。
(2)由C生成D反应方程式为_______。
(3)由B生成C的反应类型为_______。
(4)E的结构简式为_______。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式________、_______。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H2O的总质量为765g,则G的n值理论上应等于_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N≡N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3、N2、H2的体积分数都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1,逆反应速率v(NH3)=0.4 mol·(L·min)-1
A.全部B.②③④⑤⑥⑦
C.②③④⑤⑦D.③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用相应的化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)表中用序号标出的10种元素中,化学性质最不活泼的元素的原子结构示意图是___。
(2)③的单质的电子式为___,结构式为___。
(3)④、⑥、⑧的原子半径由小到大的顺序为___(用元素符号作答)。
(4)金属性最强的是___,非金属性最强的是___,②、③、⑨的最高价氧化物的水化物的酸性由弱到强的顺序是___(用化学式作答)。
(5)由表中两种元素的原子按1:1组成的共价化合物M,M为常见液态化合物,其稀液易被催化分解,请写出M的电子式___,M的结构式___。
(6)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为以正四面体向空间伸展,请写出N及其两种同素异形体的名称___、___、___。
(7)写出⑦元素的最高价氧化物对应水化物分别与元素⑥、⑧的最高价氧化物对应水化物的水溶液反应的离子方程式___、___。
(8)⑥与⑦金属性较强的是___(填元素符号),下列表述中能证明这一事实的是___。
a.⑥的单质和⑦的单质熔沸点不同
b.⑥的最高价氧化物水化物的碱性比⑦的最高价氧化物水化物的碱性强
c.⑦最外层的电子数比⑥多
d.⑦的单质与稀盐酸反应比⑥的缓和一些
(9)①和④形成的气态氢化物与①和⑧形成的气态氢化物相比较,___稳定性强;___沸点高(填化学式),理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为纪念元素周期表诞生150周年,IUPAC等从世界范围征集优秀青年化学家提名,形成一张“青年化学家元素周期表”,向世界介绍118位优秀青年化学家,有8位中国青年化学家成为“N、Hg、U”等元素的代言人。回答下列问题:
(1)N在周期表中的位置是__。
(2)下列有关性质的比较,能用元素周期律解释的是__。
a.酸性:HCl>H2SO3 b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2 d.热稳定性:Na2CO3>NaHCO3
(3)非金属性:Cl>Br,用原子结构解释原因__,用一个离子方程式证明__。
(4)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。
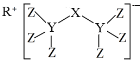
①Y的元素符号为__。②X的氢化物的电子式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com