
【题目】用如图所示装置制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备硫酸亚铁铵晶体[(NH4)xFe(SO4)y·6H2O]。硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
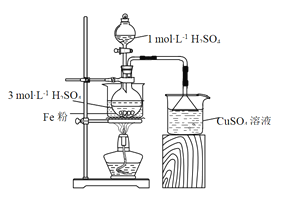
(1)实验装置:反应过程中会产生少量PH3气体,需使用封闭装置。用CuSO4溶液吸收PH3时会生成H3PO4和Cu。该反应的化学方程式为_______。
(2)药品用量:将2 g Fe粉、10 mL 3 mol·L-1 H2SO4溶液加入烧瓶中反应。采取该原料配比的主要原因是_______。
(3)制备FeSO4溶液:保持温度70~80 ℃,至反应无明显气泡产生,停止加热,过滤。
(4)制备(NH4)xFe(SO4)y·6H2O:向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80 ℃条件下溶解后,趁热倒入50 mL乙醇中,析出晶体。乙醇的作用为_______。
(5)测定化学式:将一定量(NH4)xFe(SO4)y·6H2O晶体加入到过量NaOH溶液中,并加热,生NH3 1.12 L(标准状况),过滤、洗涤、灼烧,得Fe2O3固体2.0 g。通过计算确定硫酸亚铁铵晶体的化学式。(写出计算过程)_______
【答案】4CuSO4+ PH3 + 4H2O = H3PO4 + 4H2SO4+ 4Cu↓ 避免Fe2+被氧化为Fe3+ 降低硫酸亚铁铵在水中溶解的量 (NH4)2Fe(SO4)2·6H2O
【解析】
利用硫酸铜和磷化氢反应生成铜和磷酸、硫酸,
铁与硫酸量的关系理解为何要按照此原料比加入,
根据硫酸亚铁铵不易被氧化,易溶于水,不溶于乙醇的知识推出加入乙醇的作用,
根据生成的量的关系分析铵根离子和亚铁离子的比,再根据电荷关系推出硫酸亚铁铵的化学式。
⑴用CuSO4溶液吸收PH3时会生成H3PO4和Cu。该反应的化学方程式为4CuSO4+ PH3 + 4H2O = H3PO4 + 4H2SO4+ 4Cu↓,
故答案为:4CuSO4+ PH3 + 4H2O = H3PO4 + 4H2SO4+ 4Cu↓;
⑵药品用量:将2 g Fe粉即物质的量约为0.036 mol,10 mL 3 mol·L-1 H2SO4溶液即物质的量为0.03mol,两者加入烧瓶中反应,铁粉略过量,主要是避免Fe2+被氧化为Fe3+,
故答案为:避免Fe2+被氧化为Fe3+;
⑷根据硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇,得出乙醇的作用为降低硫酸亚铁铵在水中溶解的量,
故答案为:降低硫酸亚铁铵在水中溶解的量;
⑸将一定量(NH4)xFe(SO4)y·6H2O晶体加入到过量NaOH溶液中,并加热,生成NH3 1.12 L即物质的量为0.05 mol,Fe2O3固体2.0 g绩物质的量为0.0125 mol,
n(NH3) = 0.05 mol,n(NH4+) = 0.05 mol,
n(Fe2O3) = 0.0125 mol,n(Fe) = 0.025 mol ,
n(Fe):n(NH4+) = 0.025 mol:0.05 mol = 1:2,
再根据电荷守恒得出(NH4) 2Fe(SO4)2·6H2O,
故答案为:(NH4) 2Fe(SO4)2·6H2O。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】下列有关概念或原理的叙述正确的是 ( )
A.氨基酸、蛋白质和氧化铝一样既能与酸反应,又能与碱反应,所以它们都是两性氧化物
B.制造婴儿用的一次性纸尿片采用的吸水保水的材料可以是![]()
C.乙烯和聚乙烯都能使酸性![]() 溶液褪色
溶液褪色
D.甲酸乙酯、葡萄糖、麦芽糖、淀粉这四种物质的共同性质是,它们既可以发生水解反应,又可以发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
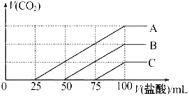
A.原NaOH溶液的浓度为0.2mol/L
B.B烧杯中通入的CO2体积为448mL
C.通入CO2后,不能确定A烧杯中的溶质
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,有pH为a的盐酸和pH为b的NaOH溶液,取VaL该盐酸,同该NaOH溶液中和,需VbLNaOH溶液,填空:
(1)若a+b=14,则Va:Vb=_________(填数字)。
(2)若a+b=13,则Va:Vb=_________(填数字)。
(3)若a+b>14,则Va:Vb=_________(填表达式),且Va__________Vb(填:>、<、=)(题中a≤6、b≥8)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种一元酸溶液各1mL, 分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示, 则下列说法正确的是

A. A、B两种酸溶液物质的量浓度一定相等
B. 稀释后A酸溶液的酸性比B酸溶液强
C. a = 5时, A是弱酸, B是强酸
D. 若A、B都是弱酸, 则5 > a > 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向l0mL0.1mol/L的HR溶液中逐渐滴入0.lmol/L的NH3·H2O 溶液,所得溶液pH及导电性变化如图。下列分析不正确的是

A. ab点导电能力增强,说明HR为弱酸
B. b点溶液,c(NH3H2O)=c(R-)+c(H+)-c(OH-)
C. c点溶液,存在c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 常温下,HR和NH3H2O的电离平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )

A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是强酸
D.该新化合物中Y满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡唑类化合物是重要的医用中间体,如图是吡唑类物质L的合成路线。
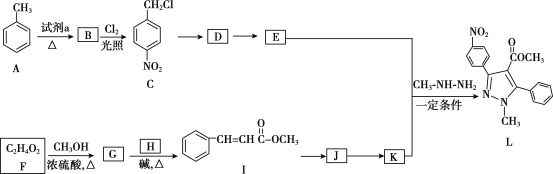
已知:R1—CHO+R2CH2—COOR3![]()
R1—CHO+R2NH2![]() R1—CH=N—R2
R1—CH=N—R2
(1)试剂a是__。
(2)C生成D的反应类型是__。
(3)D生成E的化学方程式是___。
(4)生成G的化学方程式是__。
(5)H的结构简式是__。
(6)写出符合下列条件的I的同分异构体的结构简式__。
a.是反式结构
b.能发生银镜反应
c.苯环上的一氯代物有2种
d.1mol该有机物能与2mol氢氧化钠反应
(7)K的分子式是C10H8O2,K的结构简式是__。
(8)以2-甲基丙烯和乙酸为原料,选用必要的无机试剂,合成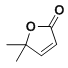 ,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg(V/V0)的变化如图所示。
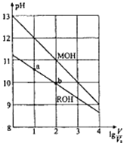
(1)MOH是___(填“强碱”或“弱碱”)。
(2)写出ROH的电离方程式___。
(3)若溶液体积相等,为了使MOH溶液与ROH溶液稀释后pH相等,加入水较多的是___。
(4)常温下,在ROH溶液中加蒸馏水稀释,下列物理量变大的是___。
A.Kw B.![]() C.c(H+) D.c(OH-)
C.c(H+) D.c(OH-)
(5)ROH的电离程度:b点___a点(填“大于”、“小于”或“等于”,下同);若无限稀释MOH、ROH溶液,最终溶液的pH:MOH溶液___ROH溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com