
【题目】大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸,请写出该反应的化学方程式:____。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示。在温度为____时,催化剂的活性最好,效率最高。请解释图中250~400℃时乙酸生成速率变化的原因:250~300℃时___;300~400℃时___。
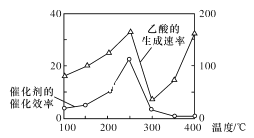
【答案】CO2+CH4![]() CH3COOH 250℃ 催化剂效率下降是影响乙酸生成速率的主要原因 温度升高是影响乙酸生成速率的主要原因
CH3COOH 250℃ 催化剂效率下降是影响乙酸生成速率的主要原因 温度升高是影响乙酸生成速率的主要原因
【解析】
CO2和CH4在催化作用下生成CH3COOH,方程式为CO2+CH4![]() CH3COOH,由图象可知,当温度低于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而增大,250℃时均达到最大值,当温度高于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而降低,温度高于300℃时,催化剂的催化效率继续降低,乙酸的生成速率却随温度的升高而增大。
CH3COOH,由图象可知,当温度低于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而增大,250℃时均达到最大值,当温度高于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而降低,温度高于300℃时,催化剂的催化效率继续降低,乙酸的生成速率却随温度的升高而增大。
CO2和CH4在催化作用下生成CH3COOH,方程式为CO2+CH4![]() CH3COOH,由图象可知,当温度低于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而增大,250℃时均达到最大值,当温度高于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而降低,温度高于300℃时,催化剂的催化效率继续降低,乙酸的生成速率却随温度的升高而增大,因此在250℃-300℃之间,催化剂是影响反应速率的主要因素,催化效率的降低,导致反应速率也降低;在300℃-400℃时,催化效率降低且变化程度较小,反应速率增加明显,因此过程中温度是影响反应速率的主要因素,温度越高,反应速率越快。
CH3COOH,由图象可知,当温度低于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而增大,250℃时均达到最大值,当温度高于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而降低,温度高于300℃时,催化剂的催化效率继续降低,乙酸的生成速率却随温度的升高而增大,因此在250℃-300℃之间,催化剂是影响反应速率的主要因素,催化效率的降低,导致反应速率也降低;在300℃-400℃时,催化效率降低且变化程度较小,反应速率增加明显,因此过程中温度是影响反应速率的主要因素,温度越高,反应速率越快。
条件 | 原则 |
从化学反应速率分析 | 既不能过快,又不能太慢 |
从化学平衡移动分析 | 既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性 |
从原料的利用率分析 | 增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本 |
从实际生产能力分析 | 如设备承受高温、高压能力等 |
从催化剂的使用活性分析 | 注意催化剂的活性对温度的限制 |


科目:高中化学 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
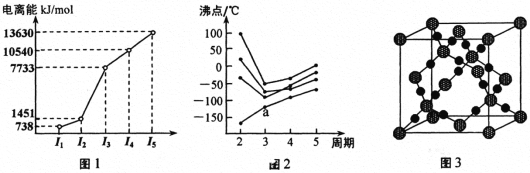
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。
(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。
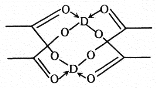
a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。
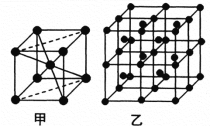
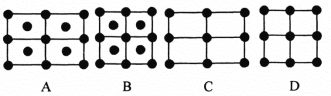
铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.在1个CsCl晶胞中含有1个Cs+
B.SO2在水中的溶解度比CO2在水中的溶解度要大
C.X、Y元素同周期,且电负性X>Y,第一电离能可能Y大于X
D.根据电子排布的特点,Cu和Ga在周期表中都属于d区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃科,以CO和氢气为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① | CO(g)+2H2(g) | K1 |
② | 2CH3OH(g) | K2 |
③ | CO(g)+H2O(g) | K3 |
回答下列问题:
工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。该工艺中反应③的发生提高了CH3OCH3的产率,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是

A. X、Y依次为阳离子、阴离子选择性交换膜
B. 负极的电极反应式:BH4-+8OH-一8e-═B(OH)4-+4H2O
C. 2室流出的溶液中溶质为Na2SO4和K2SO4
D. 电路中每转移1mol电子,电极2上有32gCu析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)是一种重要的战略金属,钴及其合金广泛应用于电机、机械、化工、航空和航天等领域。钴在化合物中通常以+2、+3的形式存在。
(1)写出基态Co原子的核外电子排布式___________________;
(2)Co2+、Co3+都能与CN-形成配位数为6的配离子。CN-中碳原子的杂化方式为_____;1mol HCN分子中σ键的数目为_________。
(3)Co的一种氧化物的晶胞如图所示(其中黑球代表Co),则该氧化物的化学式为_______,在该晶体中与一个氧离子等距离且最近的Co离子所形成的空间构型为___________。
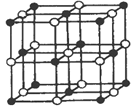
(4)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子是一种相当强的还原剂,在加热时能与水反应生成[Co(CN)6]3-,写出该反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报导,我国已研制出“可充室温钠—二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠四甘醇二甲醚,电池总反应为:4Na+3CO2![]() 2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 放电时吸收CO2,充电时释放CO2
C. 放电时Na+向碳纳米管移动
D. 放电时的负极反应为2Na-2e-+CO32-=Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一种锂离子二次电池,其工作原理如图。放电时生 成的Li2CO3固体和碳储存于碳纳米管中。下列说法错误的是
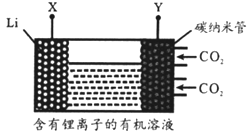
A. 该电池中的有机溶剂不能含活性较大的氢
B. 充电时,Y为阳极,Li+向X电极移动
C. 放电时,负极反应为2Li+CO32-—2e-===Li2CO3
D. 放电时,电池总反应为3CO2+4Li===2Li2CO3+C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com