
| A. | 二氧化碳使Na2O2固体变白 | B. | 氯气使KBr溶液变黄 | ||
| C. | 乙烯使Br2的四氯化碳溶液褪色 | D. | 氨气使AlCl3溶液产生白色沉淀 |
分析 A.过氧化钠与二氧化碳的反应中,二氧化碳既不是氧化剂又不是还原剂;
B.氯气将溴离子氧化成溴单质;
C.溴的化合价从0变为-1,做氧化剂,则乙烯被氧化;
D.氨气与氯化铝溶液反应生成氢氧化铝沉淀和氯化铵,该反应不属于氧化还原反应.
解答 解:A.二氧化碳与淡黄色的Na2O2反应生成白色的碳酸钠,该反应中Na2O2既是氧化剂又是还原剂,二氧化碳不是氧化剂和还原剂,故A错误;
B.氯气使KBr溶液变黄,该反应中氯气做氧化剂,反应中被还原,故B正确;
C.乙烯与溴的反应中,溴做氧化剂,乙烯被氧化,故C错误;
D.氨气与AlCl3溶液的反应不是氧化还原反应,故D错误;
故选B.
点评 本题考查氧化还原反应的应用,题目难度不大,明确氧化还原反应的实质为解答关键,注意掌握氧化反应与还原反应的区别,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
 现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大,W与R同主族,且W的氢化物常温时为液态.X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子.
现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大,W与R同主族,且W的氢化物常温时为液态.X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子.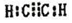 (写电子式).该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为C2H2-10e-+4H2O=2CO2+10H+.
(写电子式).该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为C2H2-10e-+4H2O=2CO2+10H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A. | 向2 mL 0.1FeCl 3的溶液中加足量铁粉,震荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D. | 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
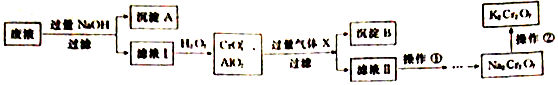
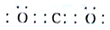 (填电子式)
(填电子式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 支持海港码头基础的防腐技术,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极.下列有关表述不正确的是( )
支持海港码头基础的防腐技术,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极.下列有关表述不正确的是( )| A. | 通入保护电流使钢管桩表面腐蚀电流接近于零 | |
| B. | 通电后外电路电子被强制从高硅铸铁流向钢管桩 | |
| C. | 高硅铸铁的作用是作为损耗阳极材料和传递电流 | |
| D. | 通入的保护电流应该根据环境条件变化进行调整 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
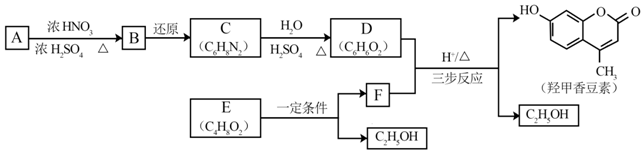
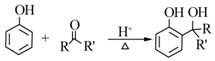
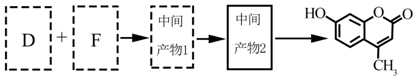
 .B中所含的官能团是硝基.
.B中所含的官能团是硝基.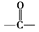 和
和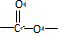 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
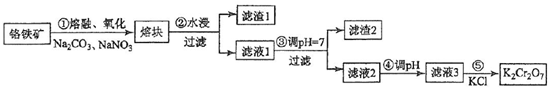
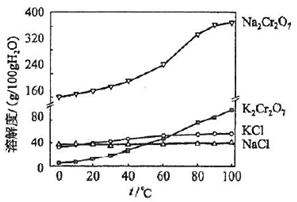
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵态氮肥和草木灰混合使用可增加肥效 | |
| B. | 氢氟酸刻蚀水晶饰品体现其酸性 | |
| C. | 电渗析法、蒸馏法、离子交换法是海水淡化的常用方法 | |
| D. | 煤经过气化和液化等物理变化可转为清洁能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com