
���� ��1��������Һ�й�����������������������Ȼ�����Ϊ�Ȼ������������ⱻ��ԭΪˮ��
��2��������Ŀ��Ϣ��ʵ����ͨ������ij�ֹ�������������ϡ�������ã����˺��Ƶýϴ�����H2O2��Һ��˵�������˳�����
��3�����������ƺͼ�ȩ��Һ���μ�����������Ϊ30%��70%�Ĺ���������Һ�У�����Ca��HCOO��2��H2O��
��� �⣺��1������������H2O2�����Ȼ����������Ȼ�����ˮ����Ӧ�����ӷ���ʽΪ��H2O2+2Fe2++2H+�T2Fe3++2H2O��
�ʴ�Ϊ��H2O2+2Fe2++2H+�T2Fe3++2H2O��
��2��ʵ����ͨ������ij�ֹ�������������ϡ�������ã����˺��Ƶýϴ�����H2O2��Һ��˵�����������ᱵ����������ѡ��BaO2��
�ʴ�Ϊ��BaO2��
��3�����������ƺͼ�ȩ��Һ���μ�����������Ϊ30%��70%�Ĺ���������Һ�У�����Ca��HCOO��2��H2O���䷴Ӧ�ķ���ʽΪ��Ca��OH��2+2HCHO+2H2O2=Ca��HCOO��2+4H2O��
�ʴ�Ϊ��Ca��OH��2+2HCHO+2H2O2=Ca��HCOO��2+4H2O��
���� ���⿼����������ԭ��Ӧ�IJ����жϡ���ѧ��Ӧ����ʽ����д���������ʵ�����Ӧ�ã������ڿ���ѧ���ķ��������ͶԻ���֪ʶ��Ӧ�����������ջ����ǹؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H=+488.3 kJ•mol-1 | B�� | ��H=-244.15 kJ•mol-1 | ||
| C�� | ��H=-977.6 kJ•mol-1 | D�� | ��H=-488.3 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Ӧ��X����ΪO2 | |
| B�� | ��Ӧ��Na2O2ֻ�������� | |
| C�� | �÷�Ӧ�з���������Ӧ�Ĺ���ֻ��FeSO4��Na2FeO4 | |
| D�� | ÿ����lmol Na2FeO4����Ӧ������ת��4 mol e- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������� | B�� | �����ס��� | C�� | ͭ�������� | D�� | п���ӡ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
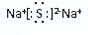 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ʵ����Ϊ��֤±�ص��������Ե�ǿ����ijС������ͼ��ʾװ�ý���ʵ�飨�г���������ȥ���������Ѽ��飩��
ʵ����Ϊ��֤±�ص��������Ե�ǿ����ijС������ͼ��ʾװ�ý���ʵ�飨�г���������ȥ���������Ѽ��飩���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3CH2Br+NaOH$��_{��}^{H_{2}O}$CH2=CH2��+NaBr+H2O | |
| B�� |  +3Br2�� +3Br2��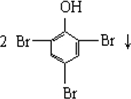 | |
| C�� | nCH2=CH-CH3$\stackrel{һ������}{��}$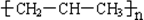 | |
| D�� | CH3CHO+NaOH+2Cu��OH��2$\stackrel{����}{��}$ CH3COONa+Cu2O��+3H2O�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����������ѧ��Fulvio Cacace���˻���˼��������о��������̬N4���ӣ�����ӽṹ��ͼ��ʾ����֪����1mol N-N����167kJ����������1mol N��N�ų�942kJ����������������Ϣ�����ݣ��ж�����˵����ȷ���ǣ�������
�����������ѧ��Fulvio Cacace���˻���˼��������о��������̬N4���ӣ�����ӽṹ��ͼ��ʾ����֪����1mol N-N����167kJ����������1mol N��N�ų�942kJ����������������Ϣ�����ݣ��ж�����˵����ȷ���ǣ�������| A�� | N4����һ�����͵Ļ����� | |
| B�� | N4������N-N����Ϊ109��28�� | |
| C�� | N4�����д��ڷǼ��Լ� | |
| D�� | 1 mol N4ת���N2������882 kJ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com