
| A. | H2B的酸性比HA的强 | |
| B. | 当NaA、NaHB、Na2B的溶液浓度都是0.1mol•L-1时,Na2B溶液pH最大 | |
| C. | HA和H2B不一定是弱酸 | |
| D. | 溶液中B2-、HB-、A-均能和强酸反应,也能和强碱反应 |
分析 A.部分电离的电解质是弱电解质,相同条件下,若酸的电离程度越大则酸的酸性越强,溶液的pH越小,其酸根离子的水解能力越小;
B.相同条件下,酸的电离程度越大,其酸性越强,则酸根离子的水解能力越小,同浓度的钠盐溶液,其pH越小;
C.如果二者都是强酸,则HA溶液的pH为1,H2B的pH小于1;
D.B2-、A-不能和强碱反应.
解答 解:HA、H2B为两种浓度均为0.1mol/L的酸溶液,常温下,如果二者都是强酸,则HA溶液的pH为1,H2B的pH小于1,实际上测得pH分别为1.5和1.8,说明这两种酸都部分电离,均为弱酸.
A.根据溶液的pH知,HA的电离程度大于H2B,所以HA的酸性大于H2B,故A错误;
B.二元弱酸的第一步电离远远大于第二步电离,所以相同条件下H2B的酸性大于HB-,故酸性强弱关系为:HA>H2B>HB-,则离子的水解能力大小顺序是B2->HB->A-,酸根离子的水解能力越大,相同浓度的钠盐其pH越大,所以Na2B的pH最大,故B正确;
C.如果二者都是强酸,则HA溶液的pH为1,H2B的pH小于1,实际上测得pH分别为1.5和1.8,说明这两种酸都部分电离,为弱酸,故C错误;
D.溶液中B2-、HB-、A-均为弱酸根,故均能和强酸反应,但B2-、A-不能和强碱反应,故D错误.
故选B.
点评 本题考查了弱电解质的电离,明确相同条件下不同弱电解质,根据弱酸电离程度与酸性强弱、溶液的pH、酸根离子水解能力的关系来分析解答,难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
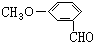 ,有多种同分异构体,其中属于芳香酸的结构简式为:
,有多种同分异构体,其中属于芳香酸的结构简式为: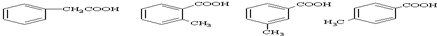 、;
、;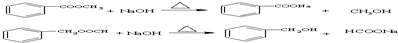 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝是地壳中含量最多的金属元素,在生活中有广泛的应用,但铝制品不宜长时间盛放腌制食品 | |
| B. | 世博停车场安装催化光解设施,可将汽车尾气中的CO和NOX反应生成无毒物质 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 高容量的储氢材料研究是推广应用氢氧燃料电池的关键问题之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
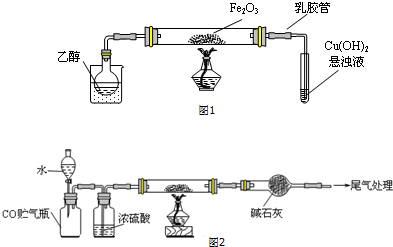
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂白液中通入少量二氧化碳:ClO-+H2O+CO2═${CO}_{3}^{2-}$+2HClO | |
| B. | 常温时偏铝酸钠溶液pH>7:${AlO}_{2}^{-}$+2H2O═Al(OH)3↓+OH- | |
| C. | 等物质的量浓度的FeI2溶液与溴水等体积混合:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| D. | 向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至沉淀完全:H++${SO}_{4}^{2-}$+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
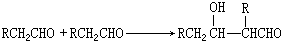
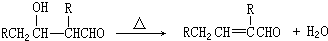

 F:
F: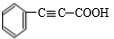

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
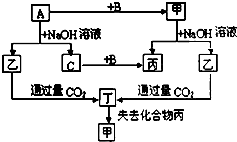 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图的转化关系,已知C为密度最小的气体,甲为非电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图的转化关系,已知C为密度最小的气体,甲为非电解质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数是34 | B. | 最高价氧化物的化学式为SeO3 | ||
| C. | 金属性比较强 | D. | 气态氢化物的化学式为H2Se |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com