
| A. | 凡金属元素与非金属元素之间都形成离子键 | |
| B. | 形成离子键的微粒必须是金属阳离子与阴离子 | |
| C. | 含有离子键的化合物中,也可能还含有共价键 | |
| D. | 非金属元素形成的化合物一定不存在离子键 |
科目:高中化学 来源: 题型:选择题
| A. | 56g铁被氧化时,失去电子数目一定是2NA | |
| B. | 常温常压下,71g Cl2中含电子总数为34NA | |
| C. | 标准状况下,2.24L SO3中,含分子总数为0.1NA | |
| D. | CnH2n+2分子中含有共价键数为(3n+1)NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
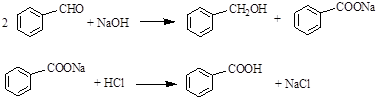
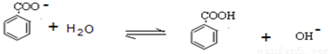 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
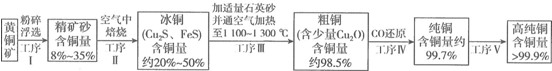
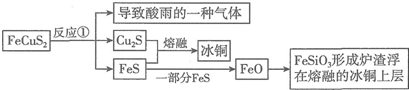
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
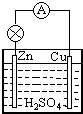 原电池是直接把化学能转化为电能的装置.如图所示:
原电池是直接把化学能转化为电能的装置.如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X=Y+0.01 | B. | X=2Y | C. | Y=2X | D. | X=Y+0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氢氧化钠的反应可自发进行,因此可用作原电池反应原理 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 铝表面可生成一层致密的氧化物薄膜,因此可用铝容器盛装稀硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com