
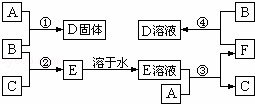
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体.在合适反应条件下,它们可以按下面框图进行反应;又知单质A是当今世界产量最大的金属,E的溶液是无色的.请回答:
(1)A是 ,B是 ,C是 (请填写化学式);
(2)反应①的化学方程式 ;
(3)反应③的离子方程式 ;
(4)反应④的离子方程式 .
考点:无机物的推断;氯气的化学性质;铁的化学性质.
专题:推断题.
分析:B为黄绿色气体,应为Cl2,单质A是当今世界产量最大的金属,应为Fe,则D为FeCl3,F能与Cl2反应生成FeCl3,则F应为FeCl2,则E为HCl的水溶液,C为H2,结合物质的相关性质解答该题.
解答: 解:B为黄绿色气体,应为Cl2,单质A是当今世界产量最大的金属,应为Fe,则D为FeCl3,F能与Cl2反应生成FeCl3,则F应为FeCl2,则E为HCl的水溶液,C为H2,则
(1)由以上分析可知,A为Fe,B为Cl2,C为H2,故答案为:Fe,Cl2,H2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为2Fe+3Cl2 2FeCl3,故答案为:2Fe+3Cl2
2FeCl3,故答案为:2Fe+3Cl2 2FeCl3;
2FeCl3;
(3)反应③为Fe和HCl的反应,反应的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(4)反应④为FeCl2和Cl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl﹣,故答案为:2Fe2++Cl2=2Fe3++2Cl﹣.
点评:本题考查无机物的推断,题目难度不大,本题注意根据物质的性质、特征作为突破口进行推断,学习中注意牢固把握元素化合物的性质,不要忽视物质的用途.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
Q、R、X、Y、Z五种元素的原子序数依次递增.已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子排布为msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4.
请回答下列问题:
(1)Z2+的核外电子排布式是 .
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的 形成配位键.
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 .
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小至大的顺序为 (用元素符号作答).
(5)Q的一种氢化物相对分子质量为26,其分子中σ键与π键的键数之比为 .
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 (填晶体类型).
查看答案和解析>>
科目:高中化学 来源: 题型:
有体积相同、 相等pH的烧碱溶液和氨水,下列叙述中正确的是 ( )
相等pH的烧碱溶液和氨水,下列叙述中正确的是 ( )
A. 两溶液物质的量浓度相同 B. 用同浓度的盐酸中和时,消耗盐酸的体积相同
C.两溶液中OH-离子浓度相同 D. 加入等体积的水稀释后,pH仍相等
查看答案和解析>>
科目:高中化学 来源: 题型:
两份铝屑,第一份与足量盐酸反应,第二份与足量NaOH溶液反应,产生的氢气的体积比为1:2(相同状况下),则第一份与第二份铝屑的质量比为( )
A.1:l B.1:2 C.1:3 D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关苯环与羟基或烷基之间的相互影响及其解释正确的是( )
A.苯酚显酸性,体现羟基对苯环的影响
B.苯与液溴反应需加催化剂,苯本分与浓溴水混合即可反应,体现苯环对羟基的影响
C.苯的硝化反应只能生成硝基苯,甲苯的硝化反应能生成三硝基甲苯,体现苯环对甲基的影响
D.甲苯能使酸性高锰酸钾溶液褪色而甲烷不能,体现苯环对甲基的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
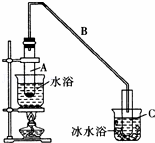
化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯.
已知: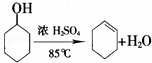
 (1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止暴沸),缓慢加热至反应安全,在试管C内得到环己烯粗品.
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止暴沸),缓慢加热至反应安全,在试管C内得到环己烯粗品.
①导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静止、分层,环己烯在 层(填“上”或“下”),分液后用 (填选项字母)洗涤.
A、KMnO4溶液 B、稀H2SO4 C、Na2CO3溶液
②蒸馏收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 (填选项字母).
A、蒸馏时从70℃开始收集产品
B、环己醇实际用量多了
C、制备粗品时环己醇随产品一起蒸出.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应能量变化图像的判断错误的是
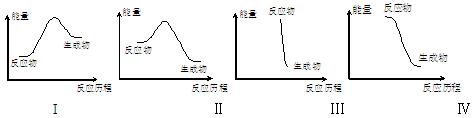
A.I可表示需加热的放热反应 B.Ⅱ可表示需加热的放热反应
C.Ⅲ可表示爆炸反应 D.Ⅳ可表示酸和碱的中和反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com