
分析 在检验氯离子时,我们可用硝酸银和稀硝酸.在检验硫酸根离子时,我们可用硝酸钡和稀硝酸.为了排除碳酸根离子的干扰,我们可以先加硝酸排除干扰,在同溶液里如果离子间能发生离子反应,则不能大量共存于同一溶液,据此分析解题.
解答 解:(1)氯化钡与硫酸钠在同一溶液中不能共存,可以相互反应,所以判断第二个方案是错误的;
(2)为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,要确定氯离子和硫酸根离子,必须排除碳酸根离子的干扰,所以首先应检验并除去碳酸根离子.所以可先加过量的硝酸,观察是否有气体生成,检验并除去碳酸根离子.在检验氯离子和硫酸根离子时,要先检验硫酸根离子,因硝酸银能跟硫酸根离子生成硫酸银,是一种微溶性物质干扰检验.所以先加过量的硝酸钡溶液,检验并除去硫酸根离子.最后再用硝酸银来检验氯离子;
故答案为(1)二;(2)HNO3,检验碳酸根离子的存在,除去碳酸根离子;Ba(NO3)2、AgNO3.
点评 在确定溶液的组成时,首先要保证所确定的溶液中的溶质必须保证能在同一溶液中共存,也就是所确定的溶质不能发生化学反应,在检验硫酸根离子和氯离子时,通常先检验硫酸根离子,排除硫酸银微溶性物质的干扰


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:选择题
可逆反应2SO2(g)+O2(g) 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应 速率与反应时间的关系如图所示.下列说法正确的是
速率与反应时间的关系如图所示.下列说法正确的是
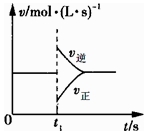
A.维持温度、容积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度、容积不变,t1时充入一定量Ar
D.维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO
2NH3(g)+CO 2(g)。不能判断该分解反应已经达到化学平衡的是
2(g)。不能判断该分解反应已经达到化学平衡的是
A.密闭容器中二氧 化碳的体积分数不变
化碳的体积分数不变
B.密闭容器中混合气体的密度不变
C.密闭容器中气体的总物质的量不变
D. v(NH3)正=2v(CO2)逆
v(NH3)正=2v(CO2)逆
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
在容积固定的4L密闭容器中进行可逆反应,X(g)+2Y(g) 2Z(g),并达到平衡。在此过程中,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t关系如图。则图中阴影部分的面积可表示 (
2Z(g),并达到平衡。在此过程中,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t关系如图。则图中阴影部分的面积可表示 (  )
)
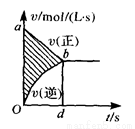
A .X的浓度的减少 B.Y物质的量的减少
.X的浓度的减少 B.Y物质的量的减少
C. Z的浓度的增加 D.X物质的量的减少
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe=2 Fe2+ | |
| D. | NaHCO3溶液与盐酸反应:HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol/L) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝土矿(Al2O3) | B. | 磁性氧化铁(FeO) | ||
| C. | 铁红(Fe2O3) | D. | 明矾[KAl(SO4)2•12H2O] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.4 g | B. | 2.2 g | C. | 5.5 g | D. | 8.2 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com