
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
科目:高中化学 来源: 题型:
【题目】可以充分说明可逆反应P(g)+Q(g)![]() R(g)+S(g)在恒温条件下达到平衡状态的事实是
R(g)+S(g)在恒温条件下达到平衡状态的事实是
A.反应器内的压强不随时间的变化而变化
B.反应器内P、Q、R、S四种气体共存
C.生成P的速率与生成S的速率相等
D.生成1molP必有1molQ生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池放电时的反应为3CO2+4Na=2Na2CO3+C,下列说法正确的是
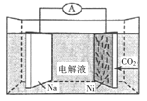
A.负载碳纳米管的镍网为电池的负极
B.充电时电池将化学能转化为电能
C.放电时,正极反应为:3CO2+4e=2CO32-+C
D.放电时Na+移向电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
n(N2O5)/mol | 10.0 | 7.0 | 5.0 | 5.0 |
下列说法正确的是( )
A.在1000s内,反应吸收的热量为2.5Q kJ
B.在500s内,O2分解速率为3×10-3 mol·L-1·s-1
C.在1000s时,反应恰好达到平衡
D.在1500s时,N2O5的正反应速率等于NO2的逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2O中含有的电子数为10NA
B.NO2和N2O4混合气体共46 g,所含原子数为3NA
C.1 mol Na2O2中含有的阴离子数为2NA
D.常温常压下,12 g 14C所含原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某原电池的装置图。其电池的总反应是:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)。请回答以下问题:
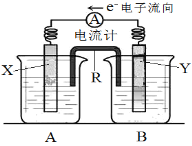
(1)R的名称是__________,R中的阳离子移向________(填“A”或“B”)中的溶液。
(2)电极Y的材料是______________,B中的电解质溶液是________________。
(3)X为原电池的______(填“正”或“负”)极,其电极反应式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用盖斯定律可计算一些不易测定的反应的反应热。
(1)已知在298K时下述反应的有关数据:C(s) +![]() O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)=2NO2(g) △H=+67.7 kJ·mol-l;
N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H=-534 kJ·mol-l。
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期中的四种主族元素A、B、C、D、E,原子序数依次增大。A是电负性最大的元素,B、D的价电子层中均有两个未成对电子,回答下列问题:
(1)B元素在周期表中的位置为___________________________;
(2)A的基态原子中,电子占据的最高能级符号为___;该能级的电子云轮廓图形状为__________;
(3)B、C、D三种元素的第一电离能大小顺序为________;该电离能大小变化的原因为________________;
(4)C、D、E三种元素的最高价氧化物的水化物的酸性强弱顺为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据水溶液中离子平衡原理回答下列问题:
I.明矾的化学式为____,明矾可用作净水剂,用离子方程式表示明矾的净水原理____
II.常温下有浓度均为0.01mol/L的下列溶液①HNO3 ②H2S ③ NaOH ④NH3·H2O ⑤NH4Cl ⑥NH4HSO4 ⑦ NaCl。回答下列问题:
(1)①②③⑤五中溶液中由水电离出的H+的浓度由大到小的顺序为______(用序号表示,下同)
(2)④⑤⑥三种溶液中NH4+浓度由大到小的顺序为__________________;
(3)①③④⑤⑥⑦六种溶液pH由大到小的顺序为_________________;
(4)等体积的③④分别与同浓度的盐酸反应至均呈中性,消耗盐酸的体积③_____④(填“大于”、“小于”、或“等于”)
(5)10mL ③与20mL⑤混合后,溶液呈_____性(填“酸”、“碱”或“中”),混合溶液中离子浓度由大到小的顺序为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com