
| A | B | C | D |
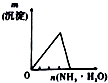
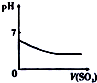
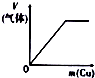
| 将氨水滴到氯化铝溶液中至过量 | 将二氧化碳逐渐通入氯水中至过量 | 将铜粉加入到浓硝酸中至过量 | 卤族元素的氧化物沸点随核电荷数的变化 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢氧化铝沉淀不能溶于过量的氨水;
B.二氧化硫与氯气反应生成盐酸和硫酸;
C.将铜粉加入到浓硝酸中至过量,一开始生成NO2,后来生成NO;
D.HF分子间存在氢键沸点最高.
解答 解:A.将氨水滴到氯化铝溶液中至过量,一开始生成氢氧化铝沉淀,当氨水过量时,氢氧化铝沉淀不能溶于过量的氨水,故A错误;
B.氯水具有强氧化性,将二氧化硫逐渐通入氯水中至过量,二氧化硫与氯气反应生成盐酸和硫酸,溶液的酸性增强,pH减小,故B正确;
C.将铜粉加入到浓硝酸中至过量,一开始Cu与浓硝酸反应生成NO2,当硝酸变为稀硝酸时,Cu与稀硝酸反应生成NO,产生气体的速率不同,所以图象不符合,故C错误;
D.HF分子间存在氢键沸点最高,则卤族元素的氢化物沸点随核电荷数的变化:HF>HBr>HCl,故D错误.
故选B.
点评 本题考查了元素化合物的性质,题目难度不大,题目涉及铝的化合物、氯水、二氧化硫、硝酸等物质,侧重于基础知识的考查.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
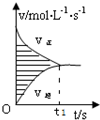 在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )
在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )| A. | 反应起始时,X、Y、Z 三种物质同时存在 | |
| B. | t1 时刻,X、Y、Z 浓度不再发生变化,反应停止 | |
| C. | 若该反应在更大的压强下进行,达平衡时,阴影部分面积不变 | |
| D. | 若该反应在加入催化剂的条件下进行,达平衡时,阴影部分面积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计或操作 | 观察或记录 | 结论或解释 |
| A | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| B | 向10mL 0.2mol/L AgNO3溶液中滴入2滴0.1mol/L NaCl溶液,产生白色沉淀后,再滴加2滴0.1mol/LKI溶液 | 白色沉淀转化为黄色沉淀 | 证明在相同温度下的Ksp:AgCl>AgI |
| C | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味气体 | 该过程中浓硫酸仅体现吸水性和脱水性 |
| D | 把SO2通入橙色的溴水中 | 橙色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Z2- | |
| C. | 同主族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5mol•L-1 | B. | 3mol•L-1 | C. | 3.5mol•L-1 | D. | 4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
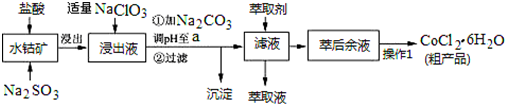
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
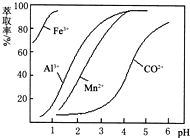
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com