
4种短周期元素相对位置如右表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题:
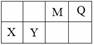
(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) = 1.3×10-3 mol·L-1。则HR  H++R-的电离平衡常数Ka= (保留一位小数)。
H++R-的电离平衡常数Ka= (保留一位小数)。
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
我国科研人员以蹄叶橐吾为原料先制得化合物Ⅰ,再转化 为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是
为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是
A.化合物Ⅰ能使酸性KMnO4溶液褪色
B. 化合物Ⅰ分子中含有5个手性碳原子
C.化合物Ⅱ一定条件下能发生取代、消去及加成反应
D. 检验化合物Ⅱ是否含化合物Ⅰ可用Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L SO3中所含有分子数为NA
B.常温下,28 g 乙烯和丙烯的混合物中所含化学键一定为6NA
C.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定为4NA
D.1 L 1mol/L NH4NO3溶液中氮原子数目小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.11.2 L CO2所含分子数为0.5 NA
B.1 L 0.1 mol·L-1的Na2S溶液中离子数为0.3 NA
C.0.5 mol FeBr2与足量氯气反应转移的电子数为NA
D.14.2 g Na2SO4固体中阴离子所带电荷数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
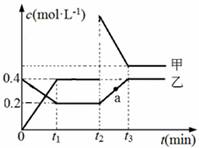
甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图所示。下列说法正确的是
A.甲是N2O4
B.a点处于平衡状态
C.t1~t2时间内v正(乙)<v逆(甲)
D.反应进行到t2时刻,改变的条件可能是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“<”、“>”或“=”);
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol 的A和0.80 mol 的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=________ mol·L-1,C的物质的量为________mol;若反应经一 段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol 氩气,平衡时A的转化率为________;
段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol 氩气,平衡时A的转化率为________;
(3)判断该反应是否达到平衡的依据为________(填正确选项前的字母);
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1 200 ℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
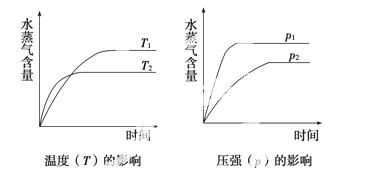
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g);ΔH<0
CO(NH2)2(s)+H2O(g);ΔH<0
B.CO2(g)+H2(g) CO(g)+H2O(g);ΔH>0
CO(g)+H2O(g);ΔH>0
C.CH3CH2OH(g) CH2===CH2(g)+H2O(g);ΔH>0
CH2===CH2(g)+H2O(g);ΔH>0
D.2C6H5CH2CH3(g)+O2(g) 2C6H5CH===CH2(g)+2H2O(g);ΔH<0
2C6H5CH===CH2(g)+2H2O(g);ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
已知可逆反应aA+bB cC中,物质的含量R%(A%和C%)随温度的变化曲线如图所示,下列说法正确的是 ( )。
cC中,物质的含量R%(A%和C%)随温度的变化曲线如图所示,下列说法正确的是 ( )。
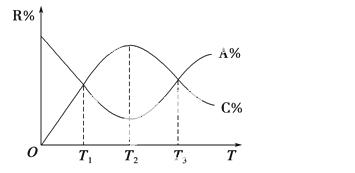
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到过化学平衡
C.该反应的逆反应是放热反应
D .升高温度,平衡会向正反应方向移动
.升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
利用醋酸二氨合铜[Cu(NH3)2Ac]溶液吸收CO,能 达到保护环境和能源再利用的目的,反应方程式为Cu(NH3)2Ac+CO+NH3
达到保护环境和能源再利用的目的,反应方程式为Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
[Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
| 温度/℃ | 15 | 50 | 100 |
| 化学平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是 ( )。
A.上述正反应为吸热反应
B.15 ℃时,反应[Cu(NH3)]Ac·CO Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
C.保持其他条件不变,减小压强,CO的转化率减小
D.醋酸二氨合铜溶液的浓度大小对CO的吸收没有影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com