
【题目】实验室以孔雀石[主要成分是CuCO3·Cu(OH)2,还含有少量杂质FeO、Fe2O3、SiO2]为原料制备CuSO4·5H2O步骤如下:
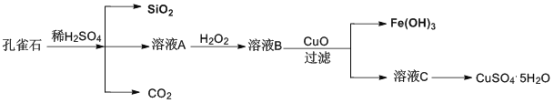
请回答下列问题:
(1)溶液A的金属离子有Fe3+和___。检验溶液A中含有Fe3的试剂是___。
(2)溶液A中加入H2O2的目的是___,发生的离子方程式为___。
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、___、过滤等操作。
(4)溶液B与CuO反应生成Fe(OH)3和溶液C的化学方程式为___。
【答案】Cu2+、Fe2+ KSCN 将Fe2+氧化为Fe3+ 2Fe2++2H++H2O2=2Fe3++2H2O 冷却结晶 Fe2(SO4)3+3CuO+3H2O=2Fe(OH)3+3CuSO4
【解析】
孔雀石的主要成分是CuCO3Cu(OH)2,还含有少量杂质FeO、Fe2O3、SiO2,加入过量稀硫酸,生成二氧化碳气体,溶液A含有硫酸铜、硫酸亚铁和硫酸铁等,加入过氧化氢,将亚铁离子氧化生成铁离子,加入CuO调节溶液pH,使铁离子水解而生成氢氧化铁沉淀,过滤分离出溶液C,C中含有硫酸铜,经蒸发、结晶可得到硫酸铜晶体,据此分析解答。
(1)由上述分析可知,溶液A的金属离子有Fe3+和Cu2+、Fe2+;检验溶液A中含有Fe3+可以选用KSCN,如果含有铁离子,则溶液变红色,故答案为:Cu2+、Fe2+;KSCN;
(2)溶液A中加入H2O2的目的是将Fe2+氧化为Fe3+,发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:将Fe2+氧化为Fe3+;2Fe2++2H++H2O2=2Fe3++2H2O;
(3)由溶液C(主要含有CuSO4)获得CuSO45H2O晶体,需要经过加热蒸发、冷却结晶、过滤等操作,故答案为:冷却结晶;
(4)溶液B[Fe2(SO4)3]与CuO反应生成Fe(OH)3和溶液C(CuSO4)的化学方程式为Fe2(SO4)3+3CuO+3H2O=2Fe(OH)3+3CuSO4,故答案为:Fe2(SO4)3+3CuO+3H2O=2Fe(OH)3+3CuSO4。


科目:高中化学 来源: 题型:
【题目】对于钠的含氧化合物的说法正确的是
A. 7.8 g Na2O2固体中含离子总数为0.3NA
B. Na2O2、Na2O组成元素相同,与CO2反应产物也相同
C. Na2O2与H2O反应时,H2O做还原剂
D. 氧化钠、过氧化钠均为离子化合物,仅含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10mL某气态烯烃在50mLO2里充分燃烧,得到液态水和体积为35mL的混合气体(同温同压下测定),该气态烯烃是( )
A. 乙烯B. 丙烯C. 1-丁烯D. 2-丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸烟有害健康,青少年应远离烟草。烟草和烟气中含有多种有害有毒物质,其中剧毒物尼古丁的结构简式如图乙所示,致癌物质苯并吡的结构如图甲所示,有关其叙述正确的是
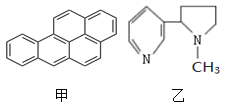
A. 尼古丁属于芳香族化合物
B. 尼古丁分子中的C、N原子均处于同一平面内
C. 苯并吡的分子式为C20H12
D. 苯并吡能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化关系的是
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | S | SO3 | H2SO4 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物水溶液,可能含有以下离子中的若干种:Na+、Ba2+、Cl﹣、CO32﹣、SO42﹣,现取200mL溶液加入BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,以下推断不正确的是
A.溶液中一定存在CO32﹣、SO42﹣、Na+B.溶液中c(Na+)≥0.6mol·L-1
C.溶液中一定没有Ba2+,可能存在Cl﹣D.溶液中n(SO42﹣)>0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制两种一定物质的量浓度的 NaOH溶液。请回答:
(1)①容量瓶上不出现的标识是___(填写字母,下同)
A.容积 B.压强 C.温度 D.密度 E.刻度线
②容量瓶所具备的功能有___。
A.可以长期贮存配制好的溶液 B.可以用来加热溶解固体溶质
C.可以用来作气体发生装置 D.配制一定体积准确浓度的标准溶液
(2)用 NaOH固体配制480mL1mol·L-1NaOH溶液,用托盘天平称取___gNaOH固体。如图为配制过程的某一步操作,该操作名称是___。
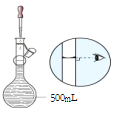
(3)该同学用上述 1mol·L-1NaOH溶液配制 250mL0.1mol·L-1的 NaOH溶液。下列仪器中不必要用到的有___。
①天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管
(4)该同学在两次配制中,以下操作使所配溶液的物质的量浓度偏大的是___。
A.准取称取 NaOH固体,待溶解后立即转移到 100mL容量瓶中并定容
B.定容并摇匀,容量瓶正立后发现液面低于刻度线,继续加蒸馏水定容
C.用少量的 1mol·L-1NaOH溶液洗涤 250mL容量瓶 2~3次
D.向容量瓶中加水至超过刻度线,用胶头滴管吸出后再定容至 100mL。
(5)若向容量瓶中转移溶液时不慎有溶液溅出,处理方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2 ![]() CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验 序号 | 温度/℃ | 初始CCl4的浓度 (mol·L-1) | 初始H2的浓度 (mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | A |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为_____________。
②实验1中,CCl4的转化率A________50%(填“大于”“小于”或“等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为________________。
④实验3中,B的值________(填序号)。
A 等于50% B 大于50% C 小于50% D 从本题资料无法判断
(2)120 ℃时,在相同条件的密闭容器中,分别进行H2 的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。

①在图中的四条线中,表示H2的起始浓度为2 mol·L-1的实验消耗CCl4的百分率变化曲线的是________(填序号)。
②根据上图曲线,氢气的起始浓度为________ mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2(SO4)3溶液可用于腐蚀绝缘板上的铜箔,制造印刷电路板。现设计了一个方案如下,从腐蚀后的废液(主要含Fe3+、Fe2+、Cu2+)中回收铜,并重新获得Fe2(SO4)3溶液。
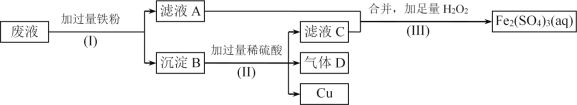
(1)步骤(I)中分离操作名称为____________________。
(2)沉淀B的主要成分有____________________,气体D的电子式为__________。
(3)写出步骤(III)中发生反应的离子方程式______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com