
某可逆反应从0―2分钟进行过程中, 在不同反应时间各物质的量的变化情况如右图所示。则该反应的的反应物是 ,生成物是 ,化学方程式为 ;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为 _____ ,若不能,则其原因为 _ ;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态。
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
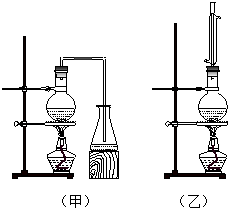 实验室制取乙酸丁酯的实验装置有如图甲、乙两种装置可供选用.
实验室制取乙酸丁酯的实验装置有如图甲、乙两种装置可供选用.| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点(℃) | 16.6 | -89.5 | -73.5 |
| 沸点(℃) | 117.9 | 117 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 可溶 (9g/100g水) |
微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分) 为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下:
(1)合成塔中反应的化学方程式为 ;△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了 。
(2)从合成塔分离出甲醇的原理与下列 操作的原理比较相符(填字母)
A.过滤 B.分液 C.蒸馏 D.结晶
工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施。“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括 。
(3)一定条件下,向体积为1 L的密闭容器中充入1 molCO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是 。
A.升高温度能使增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1
(4) 如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
巳知
写出C02(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式
___________ _____。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省启东中学高三上学期第二次月考化学试卷 题型:填空题
(14分) 为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下: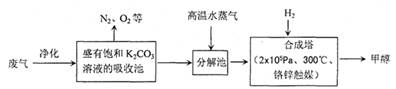
(1)合成塔中反应的化学方程式为 ;△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了 。
(2)从合成塔分离出甲醇的原理与下列 操作的原理比较相符(填字母)
A.过滤 B.分液 C.蒸馏 D.结晶
工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施。“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括 。
(3)一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是 。
A.升高温度能使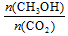 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol?L-1?min-1
(4) 如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
巳知 

写出C02(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式
___________ _____。
查看答案和解析>>
科目:高中化学 来源:2013届吉林省高一下学期期初考试化学试卷 题型:填空题
(每空2分共计12分)某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如 图所示。

①则该反应的的反应物是 ,生成物是 ,
②化学方程式为 ;
③反应开始至2分钟时,能否用C表示反应速率?
④若能,其反应速率为 ,若不能,则其原因为 ;
⑤2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态。
查看答案和解析>>
科目:高中化学 来源: 题型:
(每空2分共计12分)某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如 图所示。
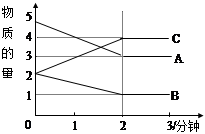
①则该反应的的反应物是 ,生成物是 ,
②化学方程式为 ;
③反应开始至2分钟时,能否用C表示反应速率?
④若能,其反应速率为 ,若不能,则其原因为 ;
⑤2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com