

���� ��1��SO2�������ã���ֹ��Ⱦ������
��2����ʼ��ӦҪ�ṩ��������������Ҫ�ˣ�˵�������Ƿ��ȷ�Ӧ��
��3������̬��ͭ����ͭ��SO2����ǰ������Ӧ���ɵ�Cu2S��Cu2O��Ӧ����Cu��SO2��
��4����Ӧ����Cu2S�������������ǻ�ԭ������Ӧ�١����ж�����O2�еĹ��ۼ����ƻ���SO2 �й��ۼ����γɣ�
��5��FeO+H2SO4=FeSO4+H2O��Fe2+���л�ԭ�ԣ���ʹ����KMnO4��Һ��ɫ��
��6������Ϣ��֪���Ի�ͭ����Ϊ0.90����Ӧת����Ϊ98%��Ϊͭ��������20���ͭ���㴦���Ļ�ͭ���ٴ���1�ֻ�ͭ��ɼ���CO2 200kg�����㣮
��� �⣺��1��SO2�������ã���ֹ��Ⱦ������������ɫ��ѧ˼�룬�ʴ�Ϊ����ɫ��ѧ��
��2����ʼ��ӦҪ�ṩ��������������Ҫ���ȣ�˵�������Ƿ��ȷ�Ӧ���ʴ�Ϊ�����ȣ�
��3�����ջ���̬��ͭ����ͭ��SO2��ǰ������Ӧ���ɵ�Cu2S��Cu2O��Ӧ����Cu��SO2����ұ����ͭ�������������Ҫ��Ӧ�Ļ�ѧ����ʽΪ2CuFeS2+O2=Cu2S+2FeS+SO2��2Cu2S+3O2=2Cu2O+2SO2��2Cu2O+Cu2S=6Cu+SO2�����ʴ�Ϊ��2CuFeS2+O2=Cu2S+2FeS+SO2��2Cu2S+3O2=2Cu2O+2SO2��2Cu2O+Cu2S=6Cu+SO2����
��4����Ӧ����Cu2S�������������ǻ�ԭ������Ӧ�١����ж�����O2�еĹ��ۼ����ƻ���SO2 �й��ۼ����γɣ��ʴ�Ϊ��BC��
��5��FeO+H2SO4=FeSO4+H2O��Fe2+���л�ԭ�ԣ���ʹ����KMnO4��Һ��ɫ����ѡ���Լ�Ϊϡ���ᡢKMnO4��Һ��ʵ������Ϊϡ�����ȡ¯�����õ���ҺʹKMnO4��Һ��ɫ��
�ʴ�Ϊ��ϡ���ᡢKMnO4��Һ��ϡ�����ȡ¯�����õ���ҺʹKMnO4��Һ��ɫ��
��6������Ϣ��֪���Ի�ͭ����Ϊ0.90����Ӧת����Ϊ98%��Ϊͭ���������20���ͭ�������Ļ�ͭ��Ϊ$\frac{20��1{0}^{4}}{\frac{1��0.9}{184}��64��98%}$=2.67��109t������1�ֻ�ͭ��ɼ���CO2200kg����ÿ��ɼ���CO2Ϊ2.67��109t��200kg/t=5.34��1011kg=5.34��104��֣�
�ʴ�Ϊ��5.34��104��
���� ���⿼��Cu���仯��������ʣ�Ϊ��Ƶ���㣬���ؽ��������������ʼ�������ԭ��ӦӦ�õĿ��飬��6���м���Ϊ�����ѵ㣬ע��ϰ���е���Ϣ��Ǩ��Ӧ�õ���������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ca2++ClO-+SO2+H2O��CaSO4��+Cl-+2H+ | |
| B�� | Ca2++2ClO-+2SO2+2H2O��CaSO4��+2Cl-+2H++SO42- | |
| C�� | Ca2++3ClO-+3SO2+3H2O��CaSO4��+3Cl-+6H++2SO42- | |
| D�� | Ca2++3ClO-+SO2+H2O��CaSO4��+2HClO+Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��� | ���ʵ�� | �Լ� | ����ͽ��� |
| �� | ����K2CO3��Na2SO3 | ϡ���ᡢ�����ʯ��ˮ | ����ʹ����ʯ��ˮ����ǵ���ɫ��ζ�������K2CO3 |
| �� | ����NO2��Br2���� | ʪ��ĵ���KI��ֽ | ��ֽ����ɫ����Br2���� |
| �� | ���������Ǻ����� | ������Һ | �������������������� |
| �� | ����AlCl3��MgCl2��Һ | ��ˮ | �Ȳ�����ɫ������Ȼ�������ʧ����AlCl3��Һ |
| A�� | �٢� | B�� | �٢� | C�� | �ڢ� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
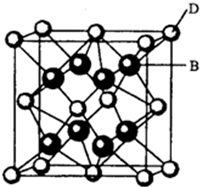
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/K | ��ӦI | ��ӦII | ��֪�� K2��K1��K2�䣾K1�� |
| 298 | K1 | K2 | |
| 398 | K1�� | K2�� |
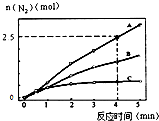
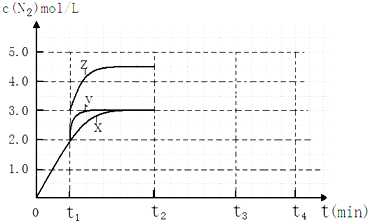
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
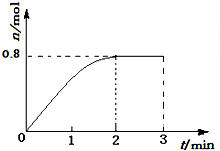 һ�������£���3molA��1molB�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A��g��+B��g��?C��g��+2D��s����2minĩ�÷�Ӧ�ﵽƽ�⣬����D�����ʵ�����ͼ�������ж���ȷ���ǣ�������
һ�������£���3molA��1molB�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A��g��+B��g��?C��g��+2D��s����2minĩ�÷�Ӧ�ﵽƽ�⣬����D�����ʵ�����ͼ�������ж���ȷ���ǣ�������| A�� | �����������ܶȲ��ٸı�ʱ���÷�Ӧ��һ���ﵽƽ��״̬ | |
| B�� | 2min��ѹ��ʹ����Ӧ���ʼӿ죬�淴Ӧ���ʱ�����ƽ�������ƶ� | |
| C�� | ��Ӧ������A��B��ת����֮��Ϊ3��1 | |
| D�� | �������´˷�Ӧ�Ļ�ѧƽ�ⳣ������ֵԼΪ0.91 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ũ��ˮ�������������屽 | |
| B�� | ��������NaOH��Һ���ȣ���ˮ������Һ��ֱ�Ӽ���AgNO3��Һ����Cl- | |
| C�� | CH4��Cl2�ڹ����������Ʊ�������CH3Cl | |
| D�� | ��ϩͨ��Br2��CCl4��Һ���Ʊ�CH2Br-CH2Br |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
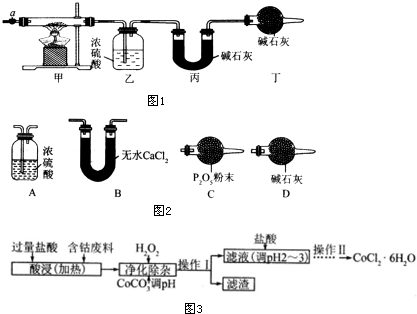
| ��װ�õ�����/g | ��װ�õ�����/g | |
| ����ǰ | 80.00 | 62.00 |
| ���Ⱥ� | 80.36 | 62.88 |
| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 |
| ��ʼ������pH�� | 2.3 | 7.5 | 7.6 | 3.4 |
| ��ȫ������pH�� | 4.1 | 9.7 | 9.2 | 5.2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com