
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)⇌MgO(s)+CO2(g)+SO2(g)△H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |

|
| A. | A | B. | B | C. | C | D. | D |
| 化学平衡的影响因素.. | |
| 专题: | 化学平衡专题. |
| 分析: | A、升温平衡正向进行,气体质量增大,根据密度等于质量除以体积分析; B、加入一氧化碳达到平衡状态,正向是压强增大的反应,一氧化碳量增大; C、平衡常数随温度变化; D、固体不影响气体达到的平衡; |
| 解答: | 解:该反应为正方向体积增加且吸热. A、升高温度,平衡正向移动,气体的质量增加,密度增大,故A正确; B、增加CO的量,平衡正向移动,但压强增大,转化的量,没有上一平衡多,故比值减小,故B错误; C、平衡常数只与温度有关,浓度变化平衡常数不变,故C错误; D、因MgSO4为固体,增加其量,对CO的转化率无影响,故D错误; 故选A. |
| 点评: | 本题考查了化学平衡的影响因素分析判断,平衡移动原理的应用,平衡常数随温度变化,固体不改变平衡是解题关键,题目难度中等 |


科目:高中化学 来源: 题型:
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示:
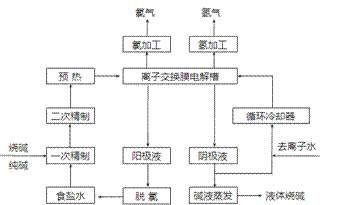
(1)该流程中可以循环的物质是 。
 (2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式 ,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式 ,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果 。
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是 ,E电极的名称是 。电解总反应的离子方程式为 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述正确的是( )
|
| A. | 已知2H2 (g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
|
| B. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol |
|
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
|
| D. | 已知C (s)+O2(g)═CO2(g)△H1;C(s)+1/2 O2(g)═CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组Na2S2O3溶液跟稀H2SO4反应的实验中,溶液中最先变浑浊的是( )
| 选项 | 反应 温度 | 反 应 物 | H2O | |||
| Na2S2O3 | H2SO4 | |||||
| t(℃) | V(mL) | c(mol×L﹣1) | V(mL) | c(mol×L﹣1) | V(mL) | |
| A | 10 | 5 | 0.1 | 10 | 0.1 | 10 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 30 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 35 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液体积比是( )
|
| A. | 1:9 | B. | 1:1 | C. | 1:2 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,且c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L•min).求:
(1)反应开始前放入容器中A、B物质的量.
(2)B的平均反应速率.
(3)x值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
A.若无固体剩余,则溶液中一定有Fe3+ B.若溶液中有Cu2+,则一定没有固体析出
C.若有固体存在,则溶液中一定有Fe2+ D.若溶液中有Fe2+,则一定有Cu析出
查看答案和解析>>
科目:高中化学 来源: 题型:
某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中H2O2只发生如下过程:H2O2  O2
O2
(1)该反应中的还原剂是
(2)该反应中,发生还原反应的过程是 
(3)写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目:
(4)若反应转移了0.3mol电子,则产生的气体在标准状况下体积为 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com